Саяпина М.С., Аверинова С.Г., Захарова Т.В., Кашкадаева А.В., Ширяев С.В., Полуэктова М.В., Воробьева О.А.
Экспериментальная и клиническая урология №3, 2017
По данным литературы описаны случаи протеинурии необратимой почечной недостаточности на фоне иммунотерапии и таргетной терапии у больных метастатическим почечно-клеточным раком (мПКР), приводящие к редукции и/или отмене препарата, что может отразиться на объективном ответе [1-4]. Все больные с мПКР после нефрэктомии должны быть отнесены к группе повышенного риска развития хронической болезни почек (ХБП).
Клиренс эндогенного креатинина до последних лет был самым широко распространенным методом для определения скорости клубочковой фильтрации (СКФ) в клинической практике. Однако в условиях умеренной и выраженной почечной недостаточности значения СКФ, рассчитанной по клиренсу эндогенного креатинина, значительно завышены, поскольку в условиях почечной недостаточности и уремии почка начинает секретировать креатинин проксимальными канальцами [5,6].
Для оценки СКФ широко внедрены в практику формулы MDRD, Кокрофта-Голта, CKD-EPI, MCQ и другие. В настоящее время есть данные, позволяющие утверждать, что скрининг-диагностика ХБП должна проводиться только на базе одновременной оценки СКФ и альбуминурии/протеинурии, что позволяет оценить прогноз и риск сердечнососудистых осложнений [7].
Классификация KDIGO, как, впрочем, RIFLE (risk, injury, failure, loss, end-stage kidney disease) и AKIN (acute kidney injury network), основанные на уровне креатинина сыворотки крови и величины диуреза, позволяют вовремя диагностировать острое почечное повреждение, имеют прогностическое значение, но не позволяют учитывать причины возникновения почечного повреждения и соответственно не всегда помогают определить профилактическую и лечебную тактику [8,9]. В связи с этим крайне актуален поиск наиболее точных биомаркеров, позволяющих диагностировать ХБП на ранней стадии и установить причину развития. На данный момент изучен целый ряд биомаркеров, ассоциированных с нефротоксичностью, но одобрены Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) и Европейским агентством лекарственных средст (EMEA) к регулярному использованию в практике только KIM-1 (kidney injury molecule-1), альбумин, общий белок, β2-микроглобулин, цистатин C, кластерин и TFF3 (trefoil factor 3) [10,11].
Отмечено, что темп прогрессирования хронической почечной недостаточности (ХПН) пропорционален скорости склерозирования почечной паренхимы, — фундаментальной составляющей патогенеза ХПН [6]. Наиболее заметную роль в этом процессе играет трансформирующий фактор роста-в (TGF-в). Сигнальные пути данного фактора роста (Smad, p38, Erk1/2, PI3K, JNK и др.) могут привести к гломерулосклерозу и тубулоинтерстициальному фиброзу с помощью нескольких патологических процессов [12]. Повышение активности TGF-в стимулирует клеточную пролиферацию и накопление компонентов внеклеточного матрикса (ВКМ), таких как коллагены I, III и IV типа, ламинин, клеточной и плазменной формы фибронектина, что способствует развитию гломерулосклероза [12].
Гемодинамические последствия гломерулярной гипертрофии, вызванной потерей почечной массы, тесно переплетены с механизмами продолжающегося в почках воспаления и фиброза через взаимодействие ангиотензина II, TGF-в и других факторов роста. Наряду с гемодинамическими эффектами, в первую очередь системным вазоконстрикторным действием, передающимся и на клубочковые капилляры, ангиотензину II присущи и так называемые негемодинамические, в том числе способность индуцировать дисфункции эндотелия, а также усиливать локально-почечную экспрессию TGF-p. Негемодинамической составляющей действия ангиотензина II отводят приоритетную роль в усилении протеинурии, и именно поэтому препараты, блокирующие его образование (ингибиторы АПФ) или взаимодействие с рецепторами 1-ого типа (блокаторы рецепторов ангиотензина II), обладают заметными антипротеинурическими свойствами [6].
Интерес представляет изучение концентрации IL-17 в сыворотке крови, обладающий сильными провоспалительными свойствами и индуцирующий тяжелую аутоиммунную патологию, в том числе и нефриты [13,14].
В последние годы широкое распространение получили в качестве веществ-маркеров гломерулотропные радиофармакологические препараты, меченные радиоизотопами, позволяющие определить СКФ [15]. Диагностическая значимость почечного очищения от нефротропных веществ (99mTc-MAG3, 123Нгиппуран, 99mTc-DTPA) тесно коррелирует с клиренсом инулина [16-18]. Однако исследования СКФ с помощью радиоактивных изотопов используются при наличии специальных радиологических лабораторий [19,20]. В лаборатории радиоизотопной диагностики ФГБНУ «РОНЦ им. Н.Н. Блохина РАМН» разработана и более 15 лет применяется в детской и взрослой клинике системная экспертиза нефро-урологического состояния на базе комплексной реносцинтиграфии (СЭНС-КР) [19,21-23]. СЭНС-КР -это высокая технология, реализованная в разработке автоматизированного рабочего места (АРМ) врача-радионефроуролога (руководитель проекта – А.П. Алехин) (рис. 1).
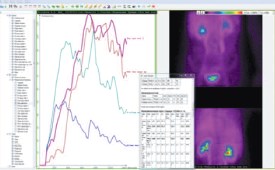
Рис. 1. Автоматизированное рабочее место, реализующее технологию СЭНС-КР на персональном компьютере путем обработки DICOM-файлов КР, получаемых на современной 2-детекторной гамма-камере.
СЭНС-КР разработана для оперативной оценки функциональных резервов мочевыделительной системы и риска почечной недостаточности. Метод КР обеспечивает не только контроль за уровнем концентрирования в паренхиме, но и раннее выявление относительного застоя в паренхиме, ее отека, уростазов в отделах чашечно-лоханочной системы (ЧЛС) и нижних мочевыводящих путях, то есть на всех функциональных структурных уровнях. Такие биохимические показатели функции почек, как креатинин и мочевина сыворотки крови, отражают уже довольно грубые морфологические изменения в почечной паренхиме и становятся диагностически значимыми, когда нефункционирующими уже оказываются 50-70% массы действующих нефронов (МДН) почки [19].
При планировании настоящего исследования предполагалось, что комплексный мониторинг функции почки по данным биохимических и радионуклидных (РН) методов позволит диагностировать факторы риска почечной недостаточности (ПН) на ранней стадии, дифференцировать структурное повреждение почки от функционального, определить их связь с токсичностью и эффективностью иммунотерапии у больных с мПКР и своевременно назначить сопутствующую терапию.
МАТЕРИАЛЫ И МЕТОДЫ
В период с 2015 по 2017 г. в данное исследование был включен 41 пациент мПКР, подвергшийся нефрэктомии. 18 пациентов получали лечение интерфероном (ИНФа), 23 пациента — ниволумабом (в рамках программы расширенного доступа BMS (компания «Бристол-Майерс Сквибб»); все пациенты подписывали информированное согласие). Из 18 пациентов, принимающих ИНФ-а, 16 пациентов (88,8%) получали его в 1-ой линии. В группе ниволумаба 12 пациентов (52%) получали ниволумаб во 2-ой линии, 11 пациентов (48%) — в 3-й и более. Медиана возраста — 56 лет. Всем пациентам до начала лечения и в процессе лечения проводились биохимический анализ крови, общий анализ мочи, проба Реберга.
До лечения и через 2 месяца от начала приема препарата определяли содержание исследуемых белков согласно стандартной методике, в сыворотке крови, полученной после центрифугирования крови со скоростью 1000 об/мин, 40С в течение 10 мин (центрифуга РС-6, Россия). Сыворотку разливали по 300400 мкл в 2 пластиковые пробирки и хранили при минус 800 С до проведения анализа. Иммуноферментные исследования проводили на базе лаборатории биохимии ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России и отделения лабораторной диагностики МРНЦ им. А.Ф. Цыба с помощью стандартных наборов для прямого иммуноферментного анализа в соответствии с инструкциями производителей IL-17-ELISA (eBio-science, США), TGF-^1-ELISA (eBio-science, США), EPO-ELISA (Biomerica, США).
Комплексную реносцинтиграфию (КР) проводили на двух-детекторной гамма-камере (E-com, Siemens) с одновременной записью в двух проекциях, что дало возможность изучить всю систему почечного очищения, начиная с сердечного кровотока и заканчивая мочевым пузырем. Диагностическая имитация почечного очищения от нефротропных веществ начинается с внутривенного введения 99тТ:-технефора. Это российский препарат из группы дифосфонатов, проявляет себя по гемодинамике как гломерулотропный препарат, концентрируясь в нефронах в основном посредством фильтрации, с частичным подключением секреции. По качеству визуализации (даже при слабой функции почек) 99т1с-технефор сопоставим с тубулотропными 99mTc-MAG3 или 1231-гиппураном, значительно превосходя традиционный гломерулотропный 99mTc-DTPA [21]. Обработку данных, записанных в двух проекциях, проводят по результатам двух-фазной регистрации: этап первый — 21-минутный (1 мин — ангиофаза) базовый тест с введением меченого вещества; этап второй — отсроченный (после 25 мин перерыва) 21-минутный досмотр (иногда 7-минутный тест) без введения радиофармпрепарата (РФП), но на фоне щадящей водной нагрузки (200-300 мл) и/или спазмолитического (реже диуретического) препарата. Опорожнение мочевого пузыря пациентом перед базовым исследованием и досмотром является обязательной функциональной пробой. При КР удалось добиться самых низких лучевых нагрузок на пациентов и персонал. При КР взрослым вводят внутривенно 74 МБк 99т1с-технефора (эффективная эквивалентная доза 0,6 мЗв), реже ""Нс-технемага; детям вводят РФП с учетом возраста и веса. При исследовании в один день почек и костной системы взрослым вводят 370-555 МБк ""Tc-технефора (эффективная эквивалентная доза 3,0-4,5 мЗв). При интерпретации данных КР применена концентрационно-скоростная модель мочевыделения и технология СЭНС-КР, разработанная в лаборатории радиоизотопной диагностики РОНЦ им. Н.Н. Блохина. Доказано, что уровень концентрирования и гло-меруло-, и тубулотропного радио-фармпрепарата в паренхиме является хорошо воспроизводимым показателем концентрационной функции почки [21,24]. Статистический анализ результатов проведен с помощью блока программ «Statistica 13.0» непараметрическим методом Спирмена (Rsp — коэффициент корреляции, незначимым считался результат при p>0,05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
В период с 2015 по 2017 г. в данное исследование был включен 41 пациент мПКР после нефрэктомии. Учитывая большее количество предшествующих линий терапии, в группе ниволумаба выше риск развития тубулоинтерстициалного нефрита (ТИН). Так, частота развития ХБП 3 стадии на момент лечения составила 35% в группе ниволумаба и 17% в группе ИНФ-а.
Воспалительное поражение почечного тубулоинтерстиция всегда клинически характеризуется нарушением концентрационной и нередко фильтрационной функции почек. Изменения почечных клубочков возможны, но носят вторичный характер [7]. Вследствие этого при радионуклидном исследовании концентрируется сниженное содержание РФП, что определяет основополагающее положение в комплексной ренографии, — «концентрационную функцию» как суммарный результат всех процессов в ренальной паренхиме [25]. В СЭНС-КР разработан алгоритм, определяющий уровень компенсации и риск дестабилизации суммарной функции почек в градациях шкалы FSS (Functional Systems Scores), суммарного прогностического индекса функционального состояния и устойчивости системы мочевыделения. Соотношение различных степеней градации клинического параметра, — ХБП согласно KDOQI и KDIGO, и РН показателя, — суммарный прогностический индекс (FSS) по данным КР с нефротропными РФП (99тТс-технефором, 99mTc-DTPA, 99тТс-технемагом, 99mTc-MAG3), представлено в таблице 1.
Таблица 1. Соотношение градации ХБП и FSS – радионуклидной оценки суммарной функции почек
| Стадия Характеристика ХБП функции почек | Уровень СКФ (мл/ мин/1,73 м2) | Характеристика FSS | Градация индекса FSS | |
|---|---|---|---|---|
| 1 | Высокая и оптимальная | >90 | Status-1 высокий уровень, незначительно снижена (устойчивая или условно-устойчивая компенсация) | 1a |
| 2 | Незначительно сниженная | 60-89 | 2b | |
| 3а | Умеренно сниженная | 45-59 | Status-2 умеренно снижена (условно-устойчивая компенсация, переходно-неустойчивый уровень компенсации) | 2а |
| 3b | Существенно сниженная | 30-44 | 2b | |
| 4 | Резко сниженная | 15-29 | Status-3 снижена от умеренной до значительной степени (неустойчивая компенсация или декомпенсация) | 3a 3b |
| 5 | Терминальная почечная недостаточность | <15 | Декомпенсация | 4 |
Темп необратимого ухудшения функции почек при большинстве вариантов ТИН значительно медленнее, чем при других хронических прогрессирующих нефропатиях. В нашем исследовании только у 1 (2,4%) пациента после двух введений ниволумаба развилась острая почечная недостаточность (ОПН). Следует отметить, что это единственный больной, у которого исходно РН-оценка суммарной функции почки была самой низкой, FSS = 3b (значительно сниженной степени). Устранение причины имеет решающее значение при ведении больного с ТИН. В данном конкретном случае у пациента, вероятно, развился канальцевый некроз еще на фоне предшествующей терапии эверолимусом (в течение двух лет), но на момент начала терапии ниволумабом СКФ, рассчитанная по формуле MDRD, составляла 41 мл/мин. В связи с развитием ОПН лечение ниволумабом было прекращено. Аутоиммунная природа ОПН была исключена. Пациент переведен на диализ.
Следует учитывать наличие сопутствующих факторов, способных усиливать выраженность поражения почек: хроническая сердечная недостаточность; сахарный диабет (СД) 2 типа; нарушение обмена мочевой кислоты. У пожилых больных возможно сочетание нескольких форм поражения почек («мультиморбидность»), например анальгетической, уратной, диабетической нефропатий, а также ишемической болезни почек (ИБП) и хронического пиелонефрита [6]. В нашем исследовании артериальная гипертония (АГ) была отмечена у 15 (36,5%) пациентов, СД 2 типа — у 4 (9,7%), мочевая инфекция — у 4 (9,7%), мочекаменная болезнь — у 2 (4,8%), ожирение — у 2 (4,8%) пациентов. Анализ биохимических и радионуклидных показателей на фоне иммунотерапии
При анализе показателей биохимического анализа крови (креатинин, мочевина), суточной пробы Реберга, общего белка в моче и суммарных и парциальных РН показателей выявлена их взаимосвязь, что подтверждает диагностическую значимость обоих методов, — биохимического и КР (табл. 2). Проанализированы 97 клинических наблюдений (в процессе мониторинга), составляющих группы пациентов после нефрэктомии на фоне терапии ИНФ-а и ниволумабом.
Таблица 2. Соотношение между биохимическими показателями и радионуклидными показателями при мониторинге функции системы мочевыделения
| N=97 | Уровень креатинина в плазме крови (112,3±24,4 мкмоль/л) | Уровень мочевины в плазме крови (7,3±2,4 ммоль/л) |
|---|---|---|
| RK — уровень компенсации | Rsp = +0,3, р<0,01 | Тенденция Rsp = +0,2 (p>0,05) |
| FSS — суммарный прогностический индекс системы мочевыделения | Rsp = +0,3, p<0,005 | p>0,05 |
| Gren — измеренный уровень концентрации 99тТс-технефора в паренхиме почки | Rsp = -0,3, p<0,001 | Rsp = -0,3, p<0,01 |
| А [сек] — артериальный показатель ренальной паренхимы | p>0,05 | p>0,05 |
| IFost — скоростной индекс устья мочеточника (при досмотре) | Rsp = -0,3, p<0,01 | p>0,05 |
Также была отмечена статистически значимая зависимость между оценкой суммарной СКФ по 24-часовой пробе Реберга и РН показателями, — D, % (скорость выведения РФП из паренхимы на уровне «кора-мозговой слой») и GB20 (20 минутный уровень концентрирования РФП в мочевом пузыре при базовом тесте КР) (рис. 2).
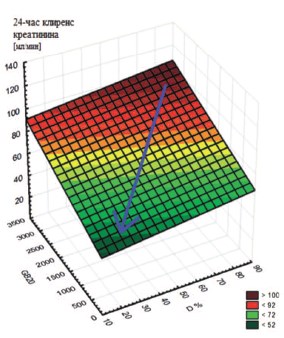
Рис. 2. Линейно сглаженная 3D-поверхность, демонстрирующая зависимость между СКФ по пробе Реберга и РН показателями, — D и GB20. Cиняя стрелка демонстрирует развитие ХТИН и нарастание риска ПН, сопровождаемое снижением скорости выведения мочи в ренальной паренхиме (D) , уровня концентрации меченой мочи, поступившей в мочевой пузырь за 20 мин базового теста КР (GB20) и СКФ, оцененной по методу Реберга (RSp = +0,4, p<0,01).
Нарастание протеинурии, вплоть до нефротического уровня, определяется прежде всего утратой селективности гломерулярной базальной мембраной и прогрессирующей подоцитарной дисфункцией. Это нарушение сопровождается также неадекватной активацией ренин-ангитензин-альдестероновой системы, типичной для многих вариантов нефротического синдрома и приводящей к усугубляющей отек ретенции натрия и осмотически связанной воды в дополнение к развившейся резистентности соответствующих сегментов нефрона к натрийуретическим пептидам [6]. Типичная для нефротического синдрома гиперкоагуляция определяется прежде всего активацией сывороточного и эндотелиального звена гемостаза, что обусловливает увеличение риска венозных тромбозов и тромбоэмболий. Это явление находит свое отражение при КР, демонстрируя зависимость между протеинурией и показателями гемодинамики паренхимы почки, — A [сек] (скорость ренальной перфузии крови, меченной РФП, артериальный показатель ренальной паренхимы) и V [%] (скорость выведения по венозным коллекторам почки крови, меченной РФП, венозный показатель ренальной паренхимы) (рис. 3).
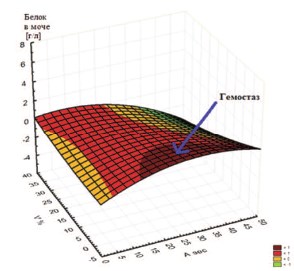
Рис. 3. 3D-поверхность (spline-сглаживание), демонстрирующая зависимость между протеинурией и показателями гемодинамики паренхимы почки, — A [сек] и V [%]. Синяя стрелка указывает на область,соответствующую выраженному гемостазу (показатели A-V), наблюдаемому при нарастании протеинурии на фоне развития ХТИН и возможной инфекции мочеполовых путей (ИМП)
В плане поиска диагностических маркеров ранних стадий нарушения почечной функции нами были проанализированы в сыворотке крови у 40 пациентов мПКР до начала иммунотерапии (ИНФ и ниволумаб) и через 2 мес после трансформирующий фактор роста-в (TGF-в) как фактор склероза почечной паренхимы и IL-17, обладающий сильными провоспалительными свойствами и индуцирующий тяжелую аутоиммунную патологию, включая нефриты. На фоне иммунотерапии с включением ИНФ-а и ниволумаба был отмечен достоверный прирост IL-17A с 0±4,29 до 0,166± 1,714 пг/мл (p<0,0005) и тенденция к росту TGF-в с 11,3± 12,4 до 13± 10,1 нг/мл (р=0,1) (рис.4).
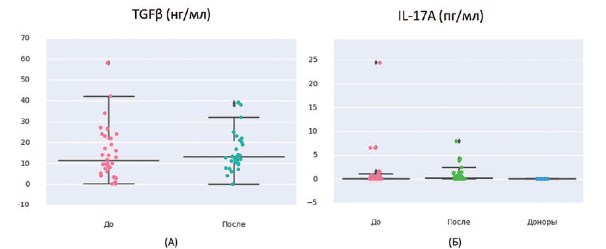
Рис. 4. А) Содержание TGF-β в сыворотке крови 40 пациентов мПКР до начала иммунотерапии с включением ИНФ-α и ниволумаба и через 2 мес. Б) Содержание IL-17A в сыворотке крови 40 пациентов мПКР до начала иммунотерапии с включением ИНФ-
α и ниволумаба и через 2 мес. (в сравнении с показателями контрольной группы, n=10)
В ходе исследования удалось сопоставить значения TGF-β и IL-17 с РН показателями, – Rnfsс, устойчивым признаком нефросклероза (предположительно, склероза междолевых артерий почки), и D, скоростью выведения 99mTc-технефора из паренхимы (на уровне «кора-мозговой слой»), соответственно (табл. 3).
Таблица 3. Соотношение данных ИФА и РН показателей
| N=40 (до начала терапии) |
TGF-β | IL-17A | ||
|---|---|---|---|---|
| До терапии | Через 2 мес | До терапии | Через 2 мес | |
| D, % — скорость выведения 99тТс-технефора из паренхимы (на уровне «кора-мозговой слой») | Тенденция Rsp = -0,3 (p>0,05) | Тенденция Rsp = -0,3 (p>0,05) | Rsp = -0,3 p<0,05 | Rsp = -0,5 p>0,005 |
| Rnfse — визуальный признак нефросклероза (склероз междолевых артерий почки) | Rsp = +0,5 p<0,05 | p>0,05 | p>0,05 | Rsp = -0,3 p<0,05 (полиурия?) |
Таким образом, увеличение концентрации TGF-β коррелирует с Rnfsс при КР, что подтверждает диагностическую значимость Rnfsс как визуального радионуклидного признака «нефросклероза», оценка которого проводилась согласно градации (табл. 4). При этом, в группе ниволумаба явления нефросклероза были значительно более выраженными по сравнению с группой ИНФ-α, что может быть обусловлено наличием большего количества предшествующих линий таргетной терапии.
Таблица 4. Шкала оценки РН визуального признака «нефросклероза» в баллах
| Rnfsс – визуальный признак «нефросклероза» | Баллы | Характерные сцинтиграммы | |
|---|---|---|---|
| Левая почка | Правая почка | ||
| Базовый тест (слева) - досмотр (справа) |
Базовый тест (слева) - досмотр (справа |
||
| Нет (?) | 0 |  |
 |
| Противоречивая картина начальных изменений | 0,5 | ||
| Недостаточно уверенный признак «нефросклероза» | 1 | ||
| Картина необратимого «нефросклероза» | 2 | ||
В то же время, повышенное значение IL-17 как до начала иммунотерапии, так и через 2 мес. соответствовало снижению скорости выведения РФП из паренхимы (D) в связи с нарастанием отека интерстиция, что подтверждает важность цитокина IL-17 в патогенезе аутоиммунных нефритов.
Следует отметить, что данные биохимические и РН маркеры позволяют не только установить нарушения почечной функции на ранней стадии, но еще и дифференцировать причину развития данной патологии — нефросклероз или аутоиммунное состояние, что имеет чрезвычайно важное значение в определении тактики лечения ХБП.
Также в группе ИНФ-а с помощью ИФА был оценен уровень эндогенного эритропоэтина у 15 пациентов мПКР после нефрэктомии до начала лечения. Полученные данные имели достоверную корреляцию с креатинином до начала лечения (Rsp = -0,6, p<0,05). Так, сниженное значение эритропоэтина соответствовало повышенной концентрации креатинина, что не противоречит патофизиологическим основам функции почек (рис. 5).
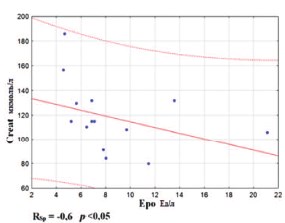
Рис. 5. Корреляция между эритропоэтином (Epo) и кретинином (Creat) в сыворотке крови у пациентов мПКР до начала лечения ИНФ-α (n=15).
Прогностическое значение лабораторно-диагностических и биохимических показателей
На первом этапе мы оценили влияние РН и биохимических показателей на риск развития ПН, определяемый по приросту креатинина и мочевины на фоне иммунотерапии ИНФ-а и ниволумабом. Данные непараметрического корреляционного анализа для показателей, потенциально значимых при прогнозе риска ПН, представлены в таблице 5. Установлены статистически значимые корреляции между приростом креатинина и IL-17, FSS, Geff, Rnfsс (рис. 6), а также между приростом мочевины и белка в моче, IL-17, D, Tev, Tpelv (рис. 7).
Таким образом, исходное значение IL-17 в сыворотке крови может являться ранним предикторным маркером развития ПН при ХБП на фоне иммунотерапии, в то время как сывороточные значения креатинина и мочевины не дали статистически значимых результатов в
плане прогноза ПН.
Таблица 5. Влияние биохимических и РН показателей на прогноз риска ПН на фоне иммунотерапии
| До начала иммунотерапии | Прирост уровня креатинина в плазме крови в 1,2 раза (±0,4) |
Прирост уровня мочевины в плазме крови в 1,6 раза (±0,6) |
|---|---|---|
| Показатели лабораторных анализов крови и мочи (n=40) | ||
| Креатинин в плазме крови | p>0,05 | p>0,05 |
| Мочевина в плазме крови | p>0,05 | p>0,05 |
| Белок в моче | Тенденция --> RSp = +0,3 (p>0,05) |
RSp = +0,5, p<0,05 |
| TGF-b1 в плазме крови | Тенденция --) RSp = +0,3 (p>0,05) |
Тенденция --> RSp = +0,3 (p>0,05 |
| IL-17 в плазме крови | RSp = +0,4, p<0,05 | RSp = +0,4, p<0,05 |
| Показатели комплексной реносцинтиграфии с 99mTc-технефором (n=31) | ||
| FSS – суммарный прогностический индекс системы мочевыделения |
RSp = +0,4, p<0,05 | p>0,05 |
| Geff – эффективный показатель концентрационной функции почки |
RSp = -0,4, p<0,05 | p>0,05 |
| D, % — скорость выведения 99mTc-технефора из паренхимы |
p>0,05 | RSp = -0,5, p<0,005 |
| Tev [мин] – время начала эвакуаторного выведения меченой мочи из чашечно-лоханочной системы почки |
RSp = +0,4, p<0,05 | RSp = +0,5, p<0,01 |
| Tpelv [мин] – время начала выведения меченой мочи из почечной лоханки |
Тенденция --> RSp = +0,3 (p>0,05 |
RSp = +0,5, p<0,005 |
| Rnfsс – визуальный признак нефросклероза | RSp = +0,4, p<0,05 | p>0,05 |
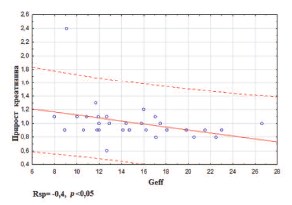
Рис. 6. Корреляция между приростом уровня креатинина в 1,2 раза (±0,4) на фоне иммунотерапии и Geff до начала терапии
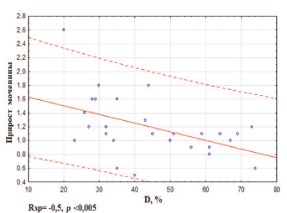
Рис. 7. Корреляция между приростом уровня мочевины в 1,6 раза (±0,6) на фоне иммунотерапии и D,% до начала терапии
Также была отмечена корреляция между РН признаком нефросклероза (Rnfsс) и приростом креатинина. Так, несмотря на отсутствие статистически значимой корреляции между сывороточным TGF-b1 и приростом креатинина, но учитывая корреляцию между TGF-b1 и Rnfsс (p<0,005), TGF-b1 можно рассматривать в качестве относительного фактора риска развития ПН на фоне иммунотерапии у больных мПКР, подвергшихся нефрэктомии.
На следующем этапе мы оценили влияние биохимических и РН показателей на эффективность иммунотерапии, оцененную согласно критериям RECIST (табл. 6).
Таблица 6. Влияние биохимических и РН показателей на эффективность иммунотерапии
| До начала иммунотерапии | Эффект лечения |
|---|---|
| Показатели лабораторных анализов крови и мочи | |
| Уровень креатинина в плазме крови Уровень мочевины в плазме крови Белок в моче TGF-|51 IL-17 | p>0,05 |
| Показатели комплексной реносцинтиграфии с 99тТс-технефором | |
| Fss — суммарный прогностический индекс системы мочевыделения | Rsp = -0,4, p<0,05 |
| Geff- эффективный показатель концентрационной функции почки | Rsp = +0,3, p<0,05 |
| Tev [мин] — время начала эвакуаторного выведения меченой мочи из чашечно-лоханочной системы почки | Rsp = -0,4, p<0,05 |
| Tpeiv [мин] — время начала выведения меченой мочи из почечной лоханки | Rsp = -0,3, p<0,05 |
Как оказалось, полученные данные КР несут прогностическую значимость не только относительно риска развития ПН, но и эффективности иммунотерапии у больных мПКР после нефрэктомии. Следует отметить, что большая часть корреляций получена за счет статистически значимых связей в группе ИНФ-α. Таким образом, у больных мПКР с лучшими функциональными параметрами почки лучше прогноз относительно эффективности иммунотерапии.
ЗАКЛЮЧЕНИЕ
Всем больным мПКР после нефрэктомии до начала лечения рекомендован биохимический контроль, а также радионуклидный (СЭНС-КР) для определения риска развития ПН на ранней стадии, а также прогноза основного заболевания и своевременной коррекции терапии с целью повышения ответа на иммунотерапию.
ЛИТЕРАТУРА
1. Khan G, Golshayan A, Elson P, Wood L, Garcia J, Bukowski R, Rini B. Sunitinib and sorafenib in metastatic renal cell. Ann Oncol 2010;21(8):1618-22. doi: 10.1093/annonc/mdp603.
2. Takahashi D, Nagahama K, Tsuura Y, Tanaka H, Tamura T. Sunitinib-induced nephrotic syndrome and irreversible renal dysfunction. Clin Exp Nephrol 2012;16(2):310-315
3. Selby P, Kohn J, Raymond J, Judson I, McElwain T. Nephrotic syndrome during treatment with interferon. Br Med J 1985;290(6476):1180.
4. Ha SH, Park JH, Jang HR, Huh W, Lim HY, Kim YG, et al. Increased risk of everolimus-associated acute kidney injury in cancer patients with impaired kidney function. BMC Cancer 2014;14:906. doi: 10.1186/1471-2407-14-906.
5. Levey AS, Atkins R, Coresh J, Cohen EP, Collins AJ, Eckardt KU, et al. Chronic kidney disease as a global public health problem: approaches and initiatives—a position statement from Kidney Disease Improving Global Outcomes. Kidney Int 2007;72(3):247-259.
6. Нефрология. [под ред. Е.М. Шилова] — М.:ГЭОТАР — Медиа, 2010.696 c.
7. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002;39(2 Suppl 1):S1-266.
8. Bellomo R, Ronco C, Kellum JA, Mehta RL, Palevsky P. Acute Dialysis Quality Initiative workgroup. Acute renal failure — definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care 2004;8(4):R204-R212.
9. Mehta RL, Kellum JA, Shah SV, Molitoris BA, Ronco C, Warnock DG, et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007;11(2):R31.
10. Любимова Н.В., Кумыкова Ж.Х., Кушлинский Н.Е. Аверинова С.Г., Кашкадаева А.В. Биохимические показатели в диагностике нефротоксичности противоопухолевой химиотерапии у детей. Вопросы онкологии 1997; 43(4): 448-453.
11. Dieterle F, Sistare F, Goodsaid F, Papaluca M, Ozer JS, Webb CP, et al. Renal biomarker qualification submission: a dialog between the FDA-EMEA and Predictive Safety Testing Consortium. Nat Biotechnol 2010;28(5):455-62. doi: 10.1038/nbt.1625.
12. Loeffler I, Wolf G.Transforming growth factor-^ and the progression of renal disease. Nephrol Dial Transplant. 2014;29 Suppl 1:i37-i45. doi: 10.1093/ndt/gft267
13. Peli^ari Kde O, Postal M, Sinicato NA, Peres FA, Fernandes PT, Marini R,et al. Serum interleukin-17 levels are associated with nephritis in childhood-onset systemic lupus erythematosus. Clinics (Sao Paulo). 2015;70(5):313-7. doi: 10.6061/clinics/2015(05)01.
14. Waite JC, Skokos D. Th17 Response and inflammatory autoimmune diseases. Int J Inflam 2012;2012:819467. doi: 10.1155/2012/819467.
15. Durand E, Prigent A. The basics of renal imaging and functional studies. Q JNucl Med. 2002;46(4):249-67.
16. Esteves FP, Halkar RK, Issa MM, Grant S, Taylor A.Comparison of camera-based 99mTc-MAG3 and 24-hour creatinine clearances for evaluation of kidney function. AJR Am J Roentgeno. 2006 Sep;187(3):W316-9.
17. Prigent А. Monitoring Renal Function and Limitation of Renal Function Tests. Semin Nucl Med 2008;38(1):32-46.
18. Gates GF. Filtration fraction and its implication for radionuclide renography using diethylenetriaminepentaacetic acid and ercaptoacetyl-triglycine. Clin Nucl Med 2004;29(4):231-7.
19. Радионуклидные исследования функции почек и уродинамики в онкологии [под ред. М.И. Давыдова, Б.И. Долгушина]. М.: Практическая медицина, 2007. 296с.
20. He W, Fischman AJ. Nuclear Imaging in the Genitourinary Tract: Recent Advances and Future Directions. Radiol Clin North Am 2008;46(1):25-43, v. doi: 10.1016/j.rcl.2008.01.006.
21. Кашкадаева А.В., Аверинова С.Г., Алехин А.П., Ширяев С.В., Дмитриева Г.Д., Захарова Т.В., и др. Диагностика факторов риска почечной недостаточности на базе концентрационно-скоростного подхода к анализу результатов комплексной реносцинтиграфии в онкологической практике. Российский электронный журнал лучевой диагностики. 2013; 3: 47-62.
22. Кашкадаева А.В., Аверинова С.Г., Дмитриева Г.Д. и др. Способ радионуклидной диагностики функции мочевыделительной системы. Патент Российской Федерации № 2001113119 (приоритет от 17 мая 2001г.) утвержден 3 июля 2002 г.
23. Averinova S.G., Kashkadaeva A.V., Shiryaev S.V., Nechipai A.M. and Dmitrieva G.D. Nephrourological Monitoring Technology Based on Functional Radionuclide Tests: Functions of an Automated Workplace. Biomedical Engineering. 1999; 33: 115-127. doi: 10.1007/BF02386159
24. Rutland M, Que L, Hassan IM. “FUR” — one size suits all. Eur J Nucl Med 2000;27(11):1708-13.
25. Arthur C. Guiton & John E. Hall. The Textbook of Medical Physiology. Elsevier Inc., 2006, New York, USA. eBook ISBN: 9781437700602
Материалы 2-й научно-практической конференции урологов Северо-Западного федерального округа Российской Федерации
21–22 апреля 2016 года, г. Cанкт-Петербург
Урологические ведомости Спецвыпуск 2016 года, стр. 59-60