Трушкин Р.Н., Лубенников А.Е., Погодина К.С.
Поликистоз почек (ПП) или аутосомно-доминантная поликистозная болезнь - самое распространенное наследственное заболевание почек [1]. Основными осложнениями со стороны кист являются: инфицирование, кровоизлияние, реже наблюдается малигнизация [1-5]. По результатам одного моноцентрового исследования инфицирование кисты (ИК) оказалась относительно редким явлением и составило всего 0,01 пациент/эпизод/год. Предрасполагающими факторами были возраст, женский пол и предшествующие трансуретральные инструментальные пособия. Также отмечалось увеличение встречаемости их у пациентов, получающих программный диализ, в тоже время после пересадки почки такой закономерности не наблюдалось [2]. ИК представляет собой серьезную опасность для здоровья и жизни, особенно у больных терминальной стадией хронической почечной недостаточности (ТХПН), у которых риск развития сепсиса и летального исхода во много раз выше, в связи с чем, своевременная диагностика нагноения в кисте крайне актуальна [3]. Несмотря на кажущуюся простоту, постановка диагноза ИК представляет трудности, как для клиницистов, так и для врачей диагностических служб. Дифференциальная диагностика ИК проводится с кровоизлиянием и злокачественным новообразованием.
Достоверно можно говорить об ИК только после получения аспирата, содержащего лейкоциты и/или бактерии, во всех остальных случаях диагноз считается вероятным [4]. Лабораторное исследование аспирата является золотым стандартом диагностики, однако пункция кисты не всегда технически выполнима из-за больших размеров почек, трудности визуализации ИК и риска травмы органов брюшной полости [2-5].
КЛИНИЧЕСКАЯ КАРТИНА И ЛАБОРАТОРНЫЕ ДАННЫЕ
Вероятный диагноз ИК устанавливается при наличии: лихорадки, боли в проекции почек/почки, высокого уровня С-реактивного белка (СРБ), лейкоцитоза, положительных посевах мочи, крови [4,5]. M.A. Lantinga и соавт. проанализировали 70 работ, опубликованных с 1948 г. по 2014 г., в которых описано в общей сложности 119 случаев ИК. Авторы выявили, что медиана лихорадки была 390С, боль в проекции почек отмечали 59-88% больных, медиана СРБ составила 55-228 мг/л, медиана лейкоцитоза - 10,7-17,4х109, отрицательные посевы мочи отмечены у 46% больных, крови - у 61% пациентов, в 88% случаев посевы мочи соответствовали посеву содержимого из кисты [5]. Грамотрицательная флора - основная этиологическая причина, приводящая к нагноению в кисте, лидирующее положение занимает E. coli, выявляемая у трети пациентов, что позволяет заподозрить восходящий путь инфицирования кист [3,4,5,6].
УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
На сегодняшний день, ультразвуковое исследование (УЗИ) нельзя рассматривать как скрининговый метод диагностики ИК. Во-первых, это связано с тем, что кровь и гной в полости кисты могут давать аналогичную эхо-картину, а во-вторых -большие размеры почек затрудняют визуализацию. Так в работе M. Sallee и соавт. данные УЗИ были положительны лишь у 6% больных с верифицированным диагнозом ИК [2].
КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ
Компьютерная томография (КТ) обладает невысокой информативностью в диагностике ИК [2,5]. Заподозрить ИК можно по наличию утолщенной стенки, неоднородному гиперденсному содержимому внутри кисты (рис. 1 а). Однако содержимое высокой плотности в кисте
наблюдаться как при наличии гнойного субстрата, так и при кровоизлиянии [7,8]. Патогномоничным КТ-признаком ИК является динамическая оценка: увеличение размеров, изменение (повышение) денсито-метрической плотности, утолщение стенки в течение короткого времени [5]. Контрастирование значимо не увеличивает информативность КТ, так как повышение плотности стенки кисты может быть связано и с воспалительным процессом, и с оставшейся функциональной паренхимой и с наличием почечно-клеточного рака [9,10]. Так в ретроспективном 10-летнем исследовании M. Sallee и соавт. с помощью КТ диагноз был поставлен лишь у 18% больных с доказанной ИК [2], в работе F. Juret и соавт. — только у 15% [4].
МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ
Магнитно-резонансная томография (МРТ) в режиме Т1, Т2 (рис. 1 в, г) более информативна по сравнению с КТ, но ложно-положительные результаты достигают 60% [2,4]. Предположить наличие ИК можно по усилению МР сигнала от стенки кисты после введения контрастного препарата [11,12]. Однако связь гадолиний-содержащего вещества с развитием нефрогенного системного фиброза ограничивает применение у больных с ХПН [5]. К другим недостаткам МРТ можно отнести длительную продолжительность исследования, влияние движений пациента на интерпретацию результатов, ограничение применение у больных с металлическими имплантантами и невозможность проведение исследования у пациентов с кардиостимулятором.
В последние годы все больше появляется публикаций, свидетельствующих о высокой информативности МРТ с использованием протоколов диффузионно-взвешенных изображений (ДВ-МРТ) (рис. 1б) [13-16]. ДВ-МРТ позволяет визуализировать и измерять случайное (броуновское) движение молекул воды. Интенсивность сигнала на диффузионно-взвешенном изображении (ДВИ) отражает диффузионную способность молекул воды исследуемого объекта [17]. Диффузия затруднена при повышении «клеточности» ткани - к примеру, при опухолях, фиброзе, абсцессах, цитотоксическом отеке [18-21], а также в структурах содержащих высокую концентрацию белка и продукты деградации гемоглобина [6]. Количественная оценка МР-диффузии достигается путем построения карт измеряемого коэффициента диффузии (ИКД) [22], однако в настоящее время достоверно не определены пороговые значения ИКД для ИК у пациентов с полики-стозом почек [5]. Тем не менее МР-диффузия является информативным дополнением к традиционным последовательностям, применяемым в МРТ. Ее использование позволяет в ряде случаев избежать введения дорогостоящих контрастных препаратов и не сопряжено с существенными временными или техническими затратами, повышая диагностическую эффективность метода [22].
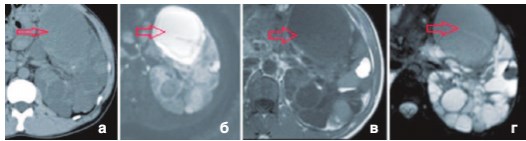
Рис. 1. а - КТ без контрастирования: увеличение плотности кисты, утолщение стенок, б - МРТ – повышение интенсивности на ДВИ от этой кисты, в - Т1 взвешенное изображение, г - Т2 взвешенное изображение демонстрируют снижение MP-сигнала
ПОЗИТРОННО-ЭМИССИОННАЯ ТОМОГРАФИЯ, СОВМЕЩЕННАЯ С КТ
По мнению ряда авторов, наиболее чувствительным методом в диагностике ИК у пациентов в поликистозом почек в настоящее время считается позитронно-эмиссионная томография, совмещенная с КТ (ПЭТ-КТ), с 18-фтор-дезоксиглюкозой (18Б-ФДГ) (рис. 2), чувствительность которой составляет 77-90% [9,23-25].
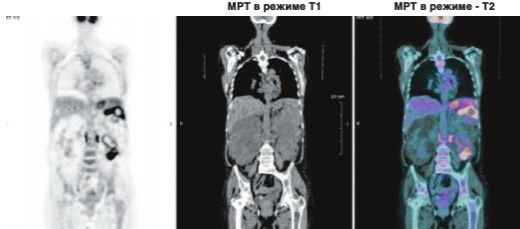
Рис. 2. ПЭТ-КТ с 18F-ФДГ. Отмечается гиперфиксация 18ФДГ в кистах верхнего и нижнего сегментах левой почки, что говорит об их инфицировании, кроме этого видно накопление 18F-ФДГ в парааортальных лимфоузлах, некоторых кистах правой почки. Накопление 18F-ФДГ желудком — физиологическое состояние
Положительными моментами данного метода диагностики являются: отсутствие нефро- и гепато-токсичности, в том числе у пациентов с начальными формами ХПН, возможность пространственной визуализации, оценка динамики степени воспалительного процесса на фоне консервативного лечения, возможность идентификации воспалительного очага в брюшной полости экстраренальной локализации. Последний момент крайне актуален у больных с ПП и лихорадкой неясного генеза. F. Jouret и соавт. сообщают о том, что у 6 больных с поликистозом почек после
ПЭТ-КТ была изменена тактика лечения. Этим пациентам проводилось исследование в связи с подозрением на ИК, однако были выявлены: холангит, дивертикулит тонкого кишечника, дивертикулит восходящего отдала толстого кишечника, простатит, пиелонефрит трансплантированной почки, воспаление в стенки аневризмы брюшного отдела аорты [25]. В публикации G. Piccoli и соавт. отмечается, что у 4-х пациентов не подтверждена ИК, однако выявлено патологическое накопление радиофармпрепарата в перипанкреатических лимфатических узлах, что было связано с наличием мезенхимальных образований [9]. Недостатками метода является высокая стоимость, ограниченная доступность, трудности дифференцировки воспалительного процесса от злокачественного, а также недостаточно данных на сегодняшний день о вероятности ложноположительных результатов при кровоизлиянии в кисту [4,25].
ЛЕЧЕНИЕ
В подавляющем большинстве доступных публикаций отмечается, что фторхинолоны являются препаратами выбора в стартовой терапии, это связано с их липофильными свойствами и возможностью создавать высокие концентрации внутри кист [2,26,27]. К сожалению, консервативная терапия в подавляющем большинстве случаев обречена на провал. Так, в 2016 году M. Lintinga и соавт. приводят результаты анализа 60 публикаций, начиная с 1948 г., в которых описывается лечение 85 пациентов с ИК. Эффекта от антибактериальной терапии удалось добиться лишь у 25% [26].
При выявлении нагноившейся кисты показано ее дренирование, бактериологический анализ содержимого, проведение этиотропной антибактериальной терапии. В случае невозможности дренирования под УЗ наведением, целесообразно использовать КТ навигацию с учетом прежде полученных данных ДВ-МРТ. Эффективность такого подхода продемонстрирована в ряде публикаций [28,29].
Отсутствие эффекта от консервативного лечения, малоинвазивных вмешательств, является показанием к ревизии почки, в ряде случаев — к нефрэктомии [26,30].
Учитывая высокий риск сепсиса, летального исхода, побочных эффектов от антибактериальной терапии у больных, получающих программный диализ, при отсутствии возможности дренирования кисты, особенно при наличии множественных ИК, показано выполнение нефрэктомии [30].
ЗАКЛЮЧЕНИЕ
Лихорадка, боль в проекции почек/почки, высокий уровень лейкоцитоза, С-реактивного белка диктуют необходимость проведение диагностических мероприятий по выявлению инфицирования кисты у пациентов с поликистозом почек. Необходимо учитывать, что бактериологическое исследование крови и мочи почти у половины пациентов оказывается отрицательным. Учитывая низкую информативность УЗИ, КТ, первым этапом при отсутствии противопоказаний целесообразно проведение ДВ-МРТ, в случае технической доступности -ПЭТ-КТ.
При выявлении ИК показано ее дренирование под УЗ наведением, в сложных случаях целесообразно использовать КТ навигацию, ориентируясь на данные МРТ-DWI.
Вероятно,антибактериальную терапию необходимо рассматривать в качестве стартового лечения только у больных с ПП, сохраненной функцией почек, отсутствием явных признаков нагноения в кисте, без факторов осложненной мочевой инфекции.
У пациентов, получающих лечение диализом, выполнение нефрэктомии при наличии ИК необходимо рассматривать как основной вариант лечения.
ЛИТЕРАТУРА
1. Torres VE, Harris PC, Pirson Y. Autosomal dominant polycystic kidney disease. Lancet 2007;369(9569):1287-1301.
2. Sallee M, Rafat C, Zahar JR, Paulmier B, Grunfeld JP, Knebelmann B, et al. Cyst infections in patients with autosomal dominant polycystic kidney disease. Clin J Am Soc Nephrol 2009;4(7):1183-1189. doi: 10.2215/CJN.01870309.
3. Christophe JL, van Ypersele, de Strihou C, Pirson Y. Complications of autosomal dominant polycystic kidney disease in 50 haemodialysed patients. A case-control study. The U.C.L. Collaborative Group. Nephrol Dial Transplant 1996;11(7):1271-1276.
4. Jouret F, Lhommel R, Devuyst, Annet L, Pirson Y, Hassoun Z, et al. Diagnosis of cyst infection in patients with autosomal dominant polycystic kidney disease: attributes and limitations of the current modalities. Nephrol Dial Transplant 2012;27(10):3746-3751. doi: 10.1093/ndt/gfs352
5. Lantinga MA, Drenth JP, Gevers TJ.Diagnostic criteria in renal and hepatic cyst infection. Nephrol Dial Transplant 2015;30(5):744-751. doi: 10.1093/ndt/gfu227
6. Юхно Е.А. Трофименко И.А. Труфанов Г.Е. Малигнизация эндометриоидных кист в аспекте магнитно-резонансного исследования: семиотика и диагностические ошибки. Опухоли женской репродуктивной системы 2013;(3):72-80.
7. Gupta S, Seith A, Dhiman RK, Chawla YK, Sud K, Kohli HS, et al. CT of liver cysts in patients with autosomal dominant polycystic kidney disease. Acta Radiol 1999;40(4):444-448.
8. Gupta S, Seith A, Sud K, Kohli HS, Singh SK, Sakhuja V, et al. CT in the evaluation of complicated autosomal dominant polycystic kidney disease. Acta Radiol 2000;41(3):280-284.
9. Piccoli GB, Arena V, Consiglio V, Deagostini MC, Pelosi E, Douroukas A, et al. Positron emission tomography in the diagnostic pathway for intracystic infection in ADPKD and ‘cystic’ kidneys. A case series. BMC Nephrol 2011;12:12-48. doi: 10.1186/1471-2369-12-48.
10. Keith DS, Torres VE, King BF, Zincki H, Farrow GM. Renal Cell Carcinoma in Autosomal Dominant Polycystic Kidney Disease. J Am Soc Nephrol 1994;4(9):1661-9.
11. Wood cG, Stromberg LG, Harmath CB, Horowitz JM, Feng C, Hammond NA, et al. CT and MR imaging for evaluation of cystic renal lesions and diseases. Radiographics 2015;35(1):125-141. doi: 10.1148/rg.351130016.
12. Migali G, Annet L, Lonneux M, Devuyst O. Renal cyst infection in autosomal dominant polycystic kidney disease. Nephrol Dial Transplant 2008;23(1):404-405.
13. Ichioka K, Saito R, Matsui Y, Terai A. Diffusion-weighted magnetic resonance imaging of infected renal cysts in a patient with polycystic kidney disease. Urology 2007;70(6):1219.
14. Katano K, Kakuchi Y, Nakashima A, Takahashi S, Kawano M. Efficacy of diffusion-weighted magnetic resonance imaging in detecting infected cysts in a case of polycystic kidney disease. Clin Nephrol 2011;75:24-26.
15. Takase Y, Kodama K, Motoi I, Saito K. Cyst infection in unilateral renal cystic disease and the role of diffusion-weighted magnetic resonance imaging. Urology 2012;80(5):61-62. doi: 10.1016/j.urology.2012.07.022.
16. Suwabe T, Ubara Y, Sumida K, Hayami N, Hiramatsu R, Yamanouchi M et al. Clinical features of cyst infection and hemorrhage in ADPKD: new diagnostic criteria. Clin Exp Nephrol 2012;16(6):892-902. doi: 10.1007/s10157-012-0650-2.
17. Mascalchi M, Filippi M, Floris R, Fonda C, Gasparotti R, Villari N. Diffusion-weighted MR of the brain: methodology and clinical application. Radiol Med 2005;109( 3):155-97.
18. Bruegel M, Holzapfel K, Gaa J, Woertler K, Waldt S, Kiefer B, et al. Characterization of focal liver lesions by ADC sequence for detection of focal liver lesions. Invest. Radiol 2008;43:261-266.
19. Lowenthal D, Zeile M, Lim WY, Wybranski C, Fischbach F, Wieners G, et al. Detection and characterization of focal liver lesions in colorectal carcinoma patients: comparison of diffusion-weighted and Gd-EOB-DTPA enhanced MR imaging. Eur Radiol 2011;21(4):832-840. doi: 10.1007/s00330-010-1977-2.
20. Miller FH, Hammond N, Siddiqi AJ, Shroff S, Khatri G, Wang Y, et al. Utility of diffusion-weighted MRI in distinguishing benign and malignant hepatic lesions. J Magn. Res. Imaging 2010;32(1):138-147. doi: 10.1002/jmri.22235.
21. Coenegrachts K, Delanote J, Ter Beek L, Haspeslagh M, Bipat S, Stoker J, et al. Improved focal liver les ion detection: comparison of singleshot diffusion-weighted echoplanar and single shot T2 weighted turbo spin echo techniques. Brit J of Radiol 2007;80(955):524-531.
22. Берген Т.А. Трофименко И.А. Методика МР-диффузии и ее применение в исследовании опухолей малого таза у женщин. Бюллетень сибирской медицины 2012;(11):10-12.
23. Bobot M, Ghez C, Gondouin B, Sallee M, Fournier PE, Burtey S, et al. Diagnostic performance of (18)F fluorodeoxyglucos positron emission tomography-computed tomography in cyst infection in patients with autosomal dominant polycystic kidney disease. Clin Microbiol Infect 2016; 22(1):71-77. doi: 10.1016/j.cmi.2015.09.024
24. Paschali AN, Georgakopoulos AT, Pianou NK, Anagnostopoulos CD. (18)F-fluorodeoxyglucose positron emission tomography/computed tomography in infected polycystic kidneydisease. World JNuclMed 2015;14(1):57-59. doi: 10.4103/1450-1147.150553.
25. Jouret F, Lhommel R, Beguin C, Devuyst O, Pirson Y, Hassoun Z, et al. Positron-emission computed tomography in cyst infection diagnosis in patients with autosomal dominant polycystic kidney disease. Clin J Am Soc Nephrol 2011;6(7):1644-1650. doi: 10.2215/CJN.06900810
26. Lantinga MA, Casteleijn NF, Geudens A, de Sevaux RG, van Assen S, Leliveld AM, et al. Management of renal cyst infection in patients with autosomal dominant polycystic kidney disease: asystematic review. Nephrol Dial Transplant. 2016. first published online January 29.
27. Suwabe T, Araoka H, Ubara Y, Kikuchi K, Hazue R, Mise K, et al. Cyst infection in autosomal dominant polycystic kidney disease: causative microorganisms and susceptibilityto lipid-soluble antibiotics. Eur J Clin Microbiol Infect Dis 2015;34(7):1369-1379. doi: 10.1007/s10096-015-2361-6
28. Kale PG, Devi BV, Lakshmi AY, Sivakumar V. Use of diffusion-weighted magnetic resonance imaging in the management of infected renal cyst in polycystic kidney disease. Indian J Nephrol 2015;25(1):60-61. doi: 10.4103/0971-4065.
29. Kato S, Hotta H, Mineta M, Miyake M. Case of infected renal cyst in polycystic kidney disease. Nihon Hinyokika Gakkai Zasshi 2013;104(3):536-539.
30. Лысенко МА, Вторенко В.И., Трушкин Р.Н., Лубенников А.Е., Сысоев А.М., Соколов А.А. Билатеральная нефрэктомия у пациентов с терминальной стадией хронической почечной недостаточности и активным течением хронического пиелонефрита. Урология 2016;(1): 46-52