Сивков А.В., Кешишев Н.Г., Меринова О.В., Северин С.Е., Савватеева М.В., Кузнецова Е.М., Раевская А.А., Каприн А.Д.
Разработка и внедрение в клиническую практику программ ранней диагностики рака предстательной железы (РПЖ) является не только важной медицинской, но большой социальной и экономической задачей государственного значения.
Около 30 лет назад тест PSA перевернул диагностику РПЖ, вызвав, при этом, значительный подъем частоты обнаружения заболевания на более ранних, курабельных стадиях [1,2,3]. Однако убедительные данные исследований свидетельствуют о недостаточной диагностической значимости данного маркера [4]. Кроме того, опубликованные наблюдения предоставили неоднозначные результаты о роли изучения PSA в снижении смертности от РПЖ [5,6]. Также, в связи с низкой специфичностью теста PSA, особую сложность представляет вопрос проведения биопсий, в особенности повторных, при уровне PSA в «серой зоне» (4-10 нг/мл) [7]. Актуальным является поиск новых маркеров РПЖ и разработка на их основе тест-систем.
На сегодняшний день выявлено более 90 различных генов и их продуктов, потенциально вовлеченных в развитие РПЖ и способных, в той или иной степени, считаться маркерами данного заболевания [8-13]. Изменения ткани предстательной железы (ПЖ) в процессе малигнизации затрагивают все основные клеточные функции и находят отражение на различных уровнях клеточных структур и процессов, таких как цитоморфологические изменения, изменения в уровне экспрессии генов и их продуктов, эпигенетические изменения.
При злокачественных заболеваниях ПЖ одними из наиболее значимых событий на молекулярном уровне являются эпигенетические изменения, в частности, статуса метилирования ДНК [10-20]. Установлено, что опухоль-специфическое гиперметилирование 5'-регуляторных областей ряда генов, приводящее к их инактивации, можно использовать для диагностики разных патологических состояний ткани предстательной железы [21]. Одной из наиболее широко описанных эпигенетических аномалий в опухолевых клетках (в том числе ПЖ) является изменение профиля метилирования промотор-ной области гена GSTnl (Glutathione-S-Transferase nl), вовлеченного в регуляцию апоптоза и утилизацию ксенобиотиков [13]. Также при малигнизации ткани ПЖ значительные эпигенетические изменения наблюдают среди генов-супрессоров опухолевого роста [21,22]. Метилирование CрG-островков в промоторных областях таких генов приводит к их инактивации и повышению риска возникновения злокачественных заболеваний.
Из большого числа инактивируемых при РПЖ супрессоров опухолевого роста нами были выбраны следующие гены: RARfi2 (Retinoic Acid Receptor ^2), гормоно-чувствительный, вовлеченный в рецептор-опосредованную супрессию опухолевого роста и RASSF1A (RAS association domain family protein 1A), участвующий в регуляции апоптоза и поддержании генетической стабильности клетки [23]. Так как получение биоптата ткани ПЖ является достаточно инвазивным методом, одной из задач данного исследования было сравнение диагностических параметров исследуемых маркеров при использовании биоматериала различных типов для разработки неинвазивного способа диагностики РПЖ.
Нами определены границы про-моторных областей выбранных генов и выявлены GC-богатые участки, а также предложены пары праймеров для амплификации метилированной и неметилированной последовательностей данных генов, которые могут быть использованы для детекции данных маркеров методом метил-специфической ПЦР
Таким образом, целью настоящей работы явилось повышение эффективности диагностики РПЖ путем определения наиболее специфичной и чувствительной комбинации указанных выше молекулярных маркеров.
МАТЕРИАЛЫ И МЕТОДЫ
Материал работы представлен результатами клинических, лабораторных и морфологических исследований 135 пациентов европеоидной расы с подозрением на РПЖ, находившихся на обследовании в НИИ урологии1 в 2009-2012 годах и 22 здоровых добровольцев. Критерием включения в основную группу пациентов было значение PSA крови от 4 до 10 нг/мл. Контрольная группа была сформирована из практически здоровых мужчин без выявленных патологических изменений в ПЖ. В данной группе не было образцов ткани ПЖ в силу отсутствия показаний к биопсии.
На основе гистологически верифицированных диагнозов были сформированы следующие экспериментальные группы:
I - группа больных хроническим простатитом вне обострения (n=46);
II - группа больных доброкачественной гиперплазией предстательной железы (ДГПЖ) с простатической интраэпителиальной неоплазией (ПИН) разной степени (n=62);
III - группа больных РПЖ (аденокарцинома ПЖ) разной степени дифференцировки (n=27);
IV - группа условно-здоровых лиц без выявленных патологических изменений в предстательной железе (n=22).
Для сравнения параметров получаемого генетического материала, эффективности проведения амплификации и с учетом экономической целесообразности исследования, были выбраны следующие типы биологического материала: цельная кровь; моча, собираемая после проведения процедуры пальцевого ректального исследования (ПРИ) предстательной железы; образцы ткани ПЖ, полученные при биопсии, как наиболее полноценный тип материала для исследования. Из данных видов биоматериала выделены образцы ДНК и сформирован банк материалов для дальнейшего изучения указанной панели молекулярных маркеров.
Для детекции изменений в статусе метилирования промоторных областей указанных выше генов использовали одну из модификаций ПЦР - метилспецифическую ПЦР (МС-ПЦР или MSP). Выделение геномной ДНК (гДНК) проводили при помощи набора реагентов Genomic
DNA Purification kit (Promega), согласно инструкции производителя. Концентрацию гДНК определяли спектрофотометрически. Затем гДНК подвергали метабисульфитной конверсии при помощи набора реагентов EpiTect® Bisulfite kit (Qiagen) согласно инструкции производителя.
Оценивали чувствительность, специфичность, предсказательную ценность положительного теста и предсказательную ценность отрицательного результата. При расчете диагностических параметров разрабатываемой системы маркеров использовали условные обозначения, определения и формулы стандартной четырехпольной таблицы (Р. Флетчер «Клиническая эпидемиология»). Также были рассчитаны показатели площади под ROC-кривой (AUC). Качество исследуемых диагностических маркеров оценивали по экспертной шкале для значений AUC.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Средний возраст пациентов с доброкачественными заболеваниями ПЖ I-II групп составил 66,6 ± 8,0 лет [M ± m] (41-82). Средний уровень PSA у этих пациентов был равен 7,0±1,8 нг/мл (4,09,9), а у больных РПЖ (III группа) -7,3±1,7 (4,7-9,7). Средний объем ПЖ в I и II группах составил 51,6±24,2 см3 (46,9-56,2), а у больных РПЖ (III) -41,4±24,3 см3 (31,8-51). Среднее значение показателя Gleason в группе с диагностированным РПЖ составило 6,6± 0,7 балла (5-8). Индекс Gleason < 6 баллов выявлен у 20 (74%) больных, >7 баллов - у 7 (26%). Среднее число «позитивных» биоптатов - 3,6±2,5 (1-12), средний процент поражения биоптата 49,3±28,0% (10-100) (табл. 1).
Таблица 1. Общая характеристика больных РПЖ (n=27)
| Показатель | Среднее значение | |
|---|---|---|
| Возраст | 67,3±8,3 (47-79) | |
| PSA | 7,3±1,7 (4,7- 9,7) | |
| Показатель Gleason | 6,3±0,7 (5-8) | |
| Среднее число «положительных» биоптатов | 3,6±2,5 (1-12) | |
| Средний % поражения биоптата | 49,3±28,0 (10-100) | |
В группе больных РПЖ отмечено следующее распределение по стадиям заболевания:
- TlcNoMo - 37% (n=10);
- Т2аШМ0 - 22% (n=6);
- T2bN0M0 - 14,8% (n=4);
- T2cN0M0 -14,8% (n=4);
- ТЗаШМО - 3,7% (n=1);
- T3bN0M0 - 7,4% (n=2).
При спектрофотометрическом определении концентрации полученной гДНК было обнаружено, что наиболее эффективное ее выделение возможно из образцов ткани ПЖ, цельной крови больных и лимфоцитов (образцы 1-4), в то время как выделение гДНК из клеток, обнаруживаемых в образцах мочи, оказалось гораздо менее эффективным (образцы 5 и 6). Таким образом, была определена наиболее перспективная среда и способ хранения биологического материала (рис. 1).
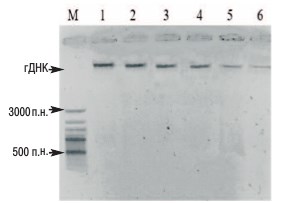
Условные обозначения:
М – маркеры молекулярной массы.
1 – гДНК, выделенная образца ткани предстательной железы, полученного при биопсии и замороженного при -70°С,
2 – гДНК, выделенная из цельной крови, замороженной при -20°С, 3,4 – гДНК, выделенная из лимфоцитов периферической крови, лизированных и замороженных при -70°С,
5 – гДНК, выделенная из клеток, обнаруженных в моче после проведения ПРИ, лизированных и замороженных при -70°С.
6 – гДНК, выделенная из клеток, обнаруженных в моче после проведения ПРИ и замороженных в PBS при -20°С.
Рис. 1. Электрофоретический анализ качества геномной ДНК, выделенной из различных типов биологического материала, хранившегося в различных условиях (0,7% агарозный гель)
Чувствительность, специфичность, предсказательная ценность положительного и отрицательного тестов были вычислены для каждого маркера в отдельности и для системы маркеров в целом. В таблице 2 отражены значения чувствительности, специфичности, положительной и отрицательной прогностической ценности исследуемых ДНК-маркеров, с учетом типа биологического материала, из которого была выделена ДНК для проведения анализа.
Таблица 2. Клинические характеристики диагностической системы маркеров РПЖ, выделенных из цельной крови, образцов ткани предстательной железы и мочи после пальцевого ректального исследования
| Показатель | Среда | Метилирование промоторной области гена | |||
|---|---|---|---|---|---|
| GSTnl | RARP2 | RASSF1A | Суммарно | ||
| Чувствительность | Кровь | 63 | 70,4 | 77,8 | 77,8 |
| Биоптат | 85,2 | 88,9 | 88,9 | 88,9 | |
| Моча | 85,2 | 66,7 | 74,1 | 74,1 | |
| Специфичность | Кровь | 59,3 | 33,3 | 57,4 | 58,3 |
| Биоптат | 68,5 | 75 | 84,3 | 84,3 | |
| Моча | 38 | 38 | 57,4 | 52,8 | |
| + PV | Кровь | 28 | 20,7 | 29,9 | 26,2 |
| Биоптат | 41,3 | 46,2 | 59,8 | 49,1 | |
| Моча | 24,4 | 21 | 29,9 | 25,1 | |
| - PV | Кровь | 86,2 | 82,5 | 89,3 | 86 |
| Биоптат | 94,9 | 95,5 | 96,5 | 95,6 | |
| Моча | 89 | 81,7 | 88,9 | 86,5 | |
| Диагностическая точность | Кровь | 60,9 | 44 | 60,6 | 33,2 |
| Биоптат | 72,8 | 77,1 | 85,7 | 60,3 | |
| Моча | 45,7 | 44,8 | 60 | 26,9 | |
При анализе характеристик диагностической системы, вычисленных на выборке образцов гДНК, выделенных из цельной крови, чувствительность составила 77,8%, а специфичность - 58,3%. Чувствительность и специфичность системы маркеров, определенная в выборке образцов гДНК, выделенных из мочи, оказалась несколько ниже: 74,1% и 52,8%, тогда как для ткани ПЖ эти показатели достигли 88,9% и 84,3%, соответственно.
Произведена оценка качества диагностической модели определения исследуемых маркеров в различных диагностических средах посредством ROC-анализа для каждого маркера в отдельности и их совокупности. При определении исследуемой панели маркеров в совокупности AUC составил: для мочи после ПРИ - 0,672 (95% ДИ 0,586 - 0,751); для крови - 0,736 (95% ДИ 0,653-0,808) и для биоптатов ПЖ - 0,891 (95% ДИ 0,826 - 0,938) (рис. 2). Согласно экспертной шкале значений AUC, эти показатели соответствуют диагностической модели среднего, хорошего и очень хорошего качества, соответственно.
Таким образом, наиболее эффективное выделение изучаемой гДНК возможно из образцов ткани ПЖ и цельной крови, в то время, как выделение ДНК из клеток, обнаруживаемых в образцах мочи, является значительно менее эффективным.
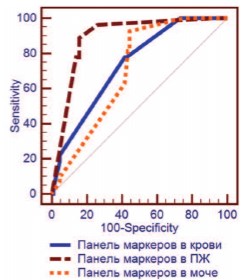
Рис. 2. ROC- кривая панели маркеров, определенных в крови, моче и биопсийном материале
Проведен корреляционный анализ зависимости экспрессии исследуемых маркеров в различных средах организма при РПЖ от других клинико-морфологических параметров. Определяли коэффициент корреляции Спирмена (г) и коэффициент значимости (р). Статистически значимая корреляционная связь была выявлена между уровнем PSA и маркером RARf$2 в крови (r=0,3950, p=0,0414). Также установлена достоверная обратная корреляция числа позитивных биоптатов с экспрессией маркера RASSF1A в моче (r=-0,4065, р=0,0354) и статистически значимая обратная корреляция объема ПЖ с экспрессией данного маркера в ткани ПЖ (r= -0,4505, р=0,0184). Такие параметры, как процент пораженного опухолью столбика, стадия заболевания, сумма баллов по шкале Gleason не выявили статистически значимой корреляции с экспрессией маркеров в различных биологических средах.
ОБСУЖДЕНИЕ
В последние годы появляется все больше исследований, посвященных генетическим маркерам РПЖ, в том числе и включенным нами в изучаемую панель. Авторы приводят различные данные об их диагностической значимости, в зависимости от метода детекции, среды определения, клинической группы и пр. (табл.3) [24].
Таблица 3. Метилированные гены, определяемые при диагностике РПЖ в биоптатах и других биологических жидкостях [24]
| Gene/Gene cohort | Specimen | Sensitivity % | Specificity % | Refs. |
|---|---|---|---|---|
| GSTP1 | Biopsy | 91 (10/11) | 100 | 52 |
| GSTP1 | Biopsy | 73 (11/15) | 100 | 141 |
| GSTP1 | Biopsy | 75 (46/61) | 100 | 142 |
| GSTP1. RAR/J2, АРС. TIG1 | Biopsy | 97 (59/61) | 100 | 144 |
| GSTP1 | Biopsy washing | 100(10/10) | 100 | 143 |
| GSTP1 | Ejaculate | 44 (4/9) | NA | 139 |
| GSTP1 | Ejaculate | 50 (4/8) | 100 | 140 |
| GSTP1 | Serum | 72 (23/32) | 100 | 140 |
| GSTP1. PTGS2. Reprimo, TIG1 | Serum | 42-47 | 92 | 148 |
| GSTP1. RASSF1. RARfi2 | Serum | 28 (24/83) | 100 | 149 |
| GSTP1 | Urine | 27 (6/22) | 100 | 145 |
| GSTP1 | Urine post massage | 36 (4/11) | 100 | 140 |
| GSTP1 | Urine post massage | 73 (29/40) | 98 | 152 |
| GSTP1 | Urine post biopsy | 39(7/18) | NA | 151 |
| GSTP1. APC EDNRB | Urine post biopsy | 71 (12/17) | NA | 153 |
| GSTP1. INK4a. ARF. MGMT | Urine | 87 (45/52) | 100 | 154 |
| GSTP1, lNK4a. ARF, MGMT, RARJ32. TIMP3, CDH1, RASSF1A, APC | Urine | 100 (52/52) (positive for at least one gene) | <100 | 154 |
| GSTP1, RARp2, APC, RASSF1A | Urine post massage | 86 | 89 | 86 |
| GSTP1. RASSF1A ECDH1, APC, DAPK. MGMT p14. p16. RARfi2. TIMP3 | Urine post massage | 93 (positive for at least one gene) | NA | 86 |
| GSTP1. RARp2. APC | Urine | 55 | 80 | 120 |
| GSTP1, ga/3 | Biopsy | 96 (26/27) | 100 | 127 |
| GSTP1. gal3 | Serum | 100(4/4) | 100 | 127 |
| GSTP1, gal3 | Urine | 100 (22/22) | NO | Unpublished |
Так, чувствительность и специфичность GSTnl (GSTP1) при исследовании биоптатов оценивают в 73-91% и 100%, в сыворотке крови - 72% и 100%, а в постмассажной порции мочи, как 36-73% и 98-100%, соответственно [25]. В нашем исследовании эти показатели оказались несколько ниже, практически во всех средах.
Чувствительность и специфичность RARfi2 в зависимости от метода исследования T. Gao c соавт. оценивают следующим образом: для биоптатов ПЖ в 54-97% и 77-100%; в моче - 35-62% и 91-97%, соответственно [24]. Отдельные авторы публикуют данные о крайне высокой эффективности определения RARfi2 в крови с использованием метода количественной ПЦР (КМС-ПЦР или QMSP): чувствительность - 98%; специфичность - 89%; AUC - 0,936 (95% ДИ 0,895 - 0,977; р< 0,001) [26]. В нашем исследовании чувствительность МС-ПЦР при определении RAR/32 в крови и специфичность во всех средах оказались несколько ниже.
Ряд авторов указывают на существование некоторых различий экспрессии генов GSTnl и RARfi2 в ткани РПЖ у мужчин кавказской и негроидной рас: AUC для GSTnl-0,969 и 0,811, а для RAR^2 - 0,969 и 0,922, соответственно [27].
По данным метаанализа J. Pan и соавт. обобщенные показатели чувствительности и специфичности RASSF1A в ткани ПЖ достигают 0,79 (95% ДИ 0,64-0,89) и 0,84 (95% ДИ 0,63-0,94), соответственно [28]. Объединенные показатели чувствительности и специфичности RASSF1A в биологических жидкостях (кровь, сыворотка, моча) - существенно ниже: 0,6 (95% ДИ 0,08-0,96) и 0,93 (95% ДИ 0,75-0,98). Эти же тенденции отмечены и в нашем исследовании.
Найдены результаты лишь одного исследования, в котором оценивали метилирование в сыворотке крови комбинации генов, аналогичной нашей (GSTnl, RARfi2 и RASSF1A), методом МС-ПЦР [29]. Чувствительность и специфичность теста по данным авторов составила 20% и 100%, соответственно, тогда как в нашей работе эти показатели были равны 77,8% и 58,3%.
Сравнение диагностических параметров разрабатываемой панели с другими маркерами РПЖ демонстрирует преобладание ее специфичности в крови относительно PSA (58,3% против 13,9%, р<0,05), при сопоставимой чувствительности. С клинической точки зрения определенный интерес представляет возможность совместного применения теста PSA и исследуемых маркеров в крови, для увеличения диагностической эффективности за счет повышения чувствительности и специфичности комбинации. Проведенные расчеты показали некоторое увеличение AUC до 0,746 (95% ДИ(0,664-0,817) при таком подходе, что соответствует диагностической модели хорошего качества (рис. 3).
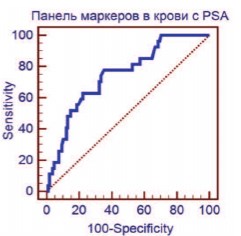
Рис. 3. ROC-кривая для совокупной панели маркеров и PSA, определенных в сыворотке крови
Специфичность изучаемой в настоящей работе панели маркеров превосходит таковую для соотношения свободного fPSA к PSA, нового маркера [-2]proPSA и PHI («индекс здоровья ПЖ), для которых при 90% чувствительности она составляет 17%, 33% и 32%, соответственно [30]. В то же время, как свидетельствуют недавно опубликованные нами данные, чувствительность и специфичность комбинации генов PCA3 и TMPRSS2-ERG при определении их в постмас-сажной порции мочи, превышает параметры изучаемой панели и составляют 83% и 78%, соответственно [31].
ЗАКЛЮЧЕНИЕ
Таким образом, одновременное использование нескольких перспективных и активно изучаемых молекулярно-генетических маркеров, таких как GSTn1, RARfi2 и RASSF1A, оправдано с учетом крайней гетерогенности и «мультифакторной» природы РПЖ. Специфичность панели превышает таковую для большинства применяемых в клинике маркеров РПЖ (PSA; fPSA; [-2]proPSA; PHI), уступая лишь PCA3 и TMPRSS2-ERG, определяемых в постмассажной моче.
По данным настоящей работы экспрессия исследуемой панели маркеров в биологических средах не связана со степенью дифференцировки РПЖ по Gleason и стадией заболевания, в связи с чем, ее использование для оценки агрессивности и стадирования РПЖ считаем нецелесообразным.
Различия диагностических показателей по отдельным генам и системе маркеров в целом, отмеченные в настоящем исследовании, по сравнению с литературными данными, вероятно, носят технологический характер и связаны с особенностями примененной методики детекции, которая требует совершенствования.
Наиболее репрезентативным типом биологического материала является ткань ПЖ, однако кровь, с точки зрения неинвазивной диагностики и скрининга - наиболее выигрышна, т.к. не требует участия специалиста для получения постмассажной мочи, а также позволяет произвести забор необходимых анализов и маркеров «единым пакетом». Диагностические параметры системы GSTn1, RARfi2 и RASSF1A, рассчитанные для определения в крови, клинически приемлемы. При совместном применении с PSA возможно создание диагностической модели хорошего качества. Клиническая и медикоэкономическая целесообразность такой комбинации требует дополнительных исследований.
ЛИТЕРАТУРА
1. Stamey TA, Yang N, Hay AR, McNeal JE, Freiha FS, Redwine E et al. Prostate-specific antigen as a serum marker for adenocarcinoma of the prostate. N Engl J Med 1987; 317(5): 909-916.
2. Cooner WH, Mosley BR, Rutherford CL Jr, Beard JH, Pond HS, Terry WJ, et al. Prostate cancer detection in a clinical urological practice by ultrasonography, digital rectal examination and prostate specific antigen. J Urol 1990; 143(6): 1146-1154.
3. Catalona WJ, Smith DS, Ratliff TL, Dodds KM, Coplen DE, Yuan JJ, et al. Measurement of prostate-specific antigen in serum as a screening test for prostate cancer. N Engl J Med 1991; 325(18): 1156-1161.
4. Yao SL, Lu-Yao G. Understanding and appreciating overdiagnosis in the PSA era. J. Natl Cancer Inst 2002; 94(13): 958-960.
5. Collin SM, Martin RM, Metcalfe C, Gunnell D, Albertsen PC, Neal D, et al. Prostate-cancer mortality in the USA and UK in 1975-2004: an ecological study. Lancet Oncol 2008; 9(5):445-52. doi: 10.1016/S1470-2045(08)70104-9.
6. Schroder FH, Hugosson J, Roobol MJ, Tammela TL, Zappa M, Nelen V et al. Screening and prostate cancer mortality: results of the European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13 years of follow-up. Lancet 2014; 384(9959):2027-35. doi: 10.1016/S0140-6736(14)60525-0.
7. Krumholtz JS, Carvalhal GF, Ramos CG, Smith DS, Thorson P, Yan Y, et al. Prostate-specific antigen cutoff of 2.6 ng/mL for prostate cancer screening is associated with favorable pathologic tumor features. Urology 2002; 60(3):469-473.
8. Schroder FH, Hugosson J, Roobol MJ, Tammela TL, Ciatto S, Nelen V, et al. Screening and prostate-cancer mortality in a randomized European study. N Engl J Med 2009; 360(13):1320-1328. doi: 10.1056/NEJMoa0810084.
9. O'Shaughnessy M, Konety B, Warlick C. Prostate cancer screening: issues and controver-sies. Minn Med 2010; 93(8):39-44.
10. Baylin SB, Herman JG, Graff JR, Vertino PM, Issa JP Alterations in DNA methy-lation: a fundamental aspect of neoplasia. Adv Cancer Res 1998; 72: 141-196.
11. Bird A. The essentials of DNA methylation. Cell 1992; 70 (1):5-8.
12. Merlo A., Herman J.G., Mao L., Lee DJ, Gabrielson E, Burger PC et al. 5' CpG island methylation is associated with transcriptional silencing of the tumor suppressor p16/CDKN2/MTS1 in human cancers. Nat Med 1995; 1(7): 686-692.
13. Herman JG, Umar A, Polyak K, Graff JR, Ahuja N, Issa JP, et al. Incidence and functional consequences of hMLH1 promoter hypermethylation in colorectal carcinoma. Proc Natl Acad Sci USA 1998; 95(12):6870-6875.
14. Hoque MO, Topaloglu O, Begum S, Henrique R, Rosenbaum E, Van Criekinge W, et al. Quantitative methylation-specific polymerase chain reaction gene patterns in urine sediment distinguish prostate cancer patients from control subjects. J Clin Oncol 2005; 23(27):6569-6575.
15. Cooper CS, Foster CS. Concepts of epigenetics in prostate cancer development. Br J Cancer 2009; 100(2): 240-245. doi: 10.1038/sj.bjc.6604771
16. Nelson WG, Yegnasubramanian S, Agoston AT, Bastian PJ, Lee BH, Nakayama M, et al. Abnormal DNA methylation, epigenetics, and prostate cancer. Front Biosci 2007; 12:4254-4266.
17. Dobosy JR, Roberts JL, Fu VX. The expanding role of epigenetics in the de-
velopment, diagnosis and treatment of prostate cancer and benign prostatic hyperplasia. J Urol 2007; 177(3):822-831.
18. Li LC. Epigenetics of prostate cancer. Front Biosci 2007; 12:3377-3397.
19. Esteller M. Cancer epigenomics: DNA methylomes and histone-modifica-tion maps. Nat Rev Genet 2007; 8(4):286-298.
20. Hoque MO, Kim MS, Ostrow KL, Liu J, Wisman GB, Park HL, et al. Genome-wide promoter analysis uncovers portions of the cancer methylome. Cancer Res 2008; 68(8):2661-2670. doi: 10.1158/0008-5472.CAN-07-5913
21. Henrique R, Jeronimo C, Teixeira MR, Hoque MO, Carvalho AL, Pais I, et al. Epigenetic heterogeneity of high-grade prostatic intraepithelial neoplasia: clues for clonal progression in prostate carcinogenesis. Mol Cancer Res 2006; 4 (1):1-8.
22. Jeronimo C, Henrique R, Hoque MO, Mambo E, Ribeiro FR, Varzim G, et al. A quantitative promoter methylation profile of prostate cancer. Clin Cancer Res 2007; 10:8472-8478.
23. Aitchison A, Warren A, Neal D, Rabbitts P. RASSF1A promoter methylation is frequently detected in both pre-malignant and non-malignant microdissected prostatic epithelial tissues. Prostate 2007; 67(6):638-644.
24. Gao T, He B, Pan Y, Li R, Xu Y, Chen L, Nie Z, Gu L, Wang S. The association of retinoic acid receptor beta2 (RARb2) methylation status and prostate cancer risk: A Systematic Review and Meta-Analysis. PLOS One 2013; 8(5):62950. doi: 10.1371/journal.pone.0062950
25. Ahmed H. Promoter Methylation in Prostate Cancer and its Application for the Early Detection of Prostate Cancer Using Serum and Urine Samples. Biomarkers in Cancer 2010; 2010(2):17-33.
26. Dumache R, Puiu M, Minciu R, Bardan R, David D, Tudor A, Bumbacila B. Retinoic acid receptor |32 (RAR|32): nonivasive biomarker for distinguishing malignant versus benign prostate lesions from bodily fluids. Chirurgia (Bucur) 2012; 107(6):780-784.
27. Kwabi-Addo B, Wang S, Chung W, Jelinek J, Patierno S, Wang B, et al. Identification of Differentially Methylated Genes in Normal Prostate Tissues from African American and Caucasian Men. Clin Cancer Res 2010; 16(14):3539-3547. doi: 10.1158/1078-0432.CCR-09-3342
28. Pan J, Chen J, Zhang B, Chen X, Huang B, Zhuang J, Mo C, et al. Association between RASSF1A promoter methylation and prostate cancer: a systematic review and meta-analysis. PLOS One 2013; 8(9):75283. doi:10.1371/ journal.pone.0075283
29. Sunami E, Shinozaki M, Higano CS, Wollman R, Dorff TB, Tucker SJ, et al. Multimarker circulating DNA assay for assessing blood of prostate cancer patients. Clin Chem 2009; 55(3):559-567. doi: 10.1373/clinchem.2008.108498
30. Filella X, Gimenez N. Evaluation of [-2]proPSA and Prostate Health Index (phi) for the detection of prostate cancer: a systematic review and meta-analysis. Clin Chem Lab Med 2013; 51(4):729-739. doi: 10.1515/cclm-2012-0410.
31. Sivkov A, Efremov G, Mihaylenko D, Apolikhin O. PCA3 and TMPRSS2-ERG for prostate cancer diagnosis. 8th European Multidisciplinary Meeting on Urological Cancers