Набока Ю.Л.1 , Чибичян М.Б.2 , Ильяш А.В.2
1 Кафедра микробиологии и вирусологии №1 ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
2 Кафедра урологии и репродуктивного здоровья человека с курсом детской урологии-андрологии ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
Введение
В исследованиях последних лет, посвященных патогенезу доброкачественной гиперплазии предстательной железы (ДГПЖ), наряду с основными факторами, определяющими развитие и прогрессию данного заболевания (возраст, андрогены), потенциально важную роль отводят воспалительной реакции в ткани железы [1-6]. Кроме того, в литературе обсуждается роль инфекции в развитии рака предстательной железы (РПЖ) [5-11]. В связи с этим, особый интерес могут представлять исследования, направленные на выявление различий в микробном спектре ткани простаты при РПЖ и ДГПЖ.
Нами инициирована работа, цель которой заключалась в определении бактерий, специфичных для РПЖ и ДГПЖ, а также уровня обсемененности ткани простаты при данных заболеваниях.
Материалы и методы
В результате обследования, проведенного по поводу заболевания предстательной железы, отобрано 68 пациентов, имеющих показания к выполнению пункционной биопсии предстательной железы.
Методика биопсии включала забор 12-22 биоптатов под трансректальным ультразвуковым контролем. Помимо основных биоптатов для морфологического исследования, дополнительно, не меняя положения датчика ультразвукового аппарата, проводили забор материала для бактериологического исследования. По одному биоптату из периферической и центральной зон справа и слева – всего 4 биоптата. Для исключения контаминации исследуемого материала микрофлорой желудочно-кишечного тракта, в прямую кишку за 30 минут до исследования вводили 20 мл 0,02% раствора хлорофиллипта.
Посев биоптатов проводили на расширенный набор питательных сред. Для определения факультативно-анаэробных бактерий использовали среды Эндо, ХайХром-селективный агар для энтерококков, ХайХром-селективный агар для грибов Candida, желточно-солевой агар, 10% кровяной агар, приготовленный на основе агара Мюллера-Хинтона с добавлением бараньих эритроцитов. Для выделения неклостридиально-анаэробных бактерий использовали среды Блаурокка, Мюллеера-Хинтона, агар и бульон Шедлера, желчно-эскулиновый агар для бактероидов. Посевы инкубировали в аэробных и анаэробных (10% СО2, 10% Н2, 80% N2) условиях культивирования в течение 2-4 суток. Идентификацию выделенных бактерий проводили по морфологическим, тинкториальным, культуральным и биохимическим признакам с помощью энтеро-, стафило-, неферм-, анаэротестов (Lachema, Чехия).
Пациенты были разделены на две группы в зависимости от результатов морфологического исследования: 1 группа – 39 (57,4%) пациентов с ДГПЖ, 2 группа – 29 (42,6%) пациентов с РПЖ (таблица 1).
Таблица 1. Клиническая характеристика пациентов
| 1 группа ДГПЖ (п=39) | 2 группа РПЖ (п=29) | |
| Возраст | 64,6±1,4 (44-81) | 67,3±1,5 (47-80) |
| ПСА общий (нг/мл) | 8,6±0,9( 1,2-28,8) | 22,2±4,9( 1,2-100)* |
| ПСА плотность (нг/мл/см3) | 0,15±0,08 | 0,19±0,04 |
| ПСА св./общ. (%) | 14,8±1,4 | 10,1±1,5 |
| Объем предстательной железы (см ) | 63,9±7,9 (29-288) | 56,2±4,7 (23-121) |
| Пальпируемые очаги | 7(17,95%) | 18(62,1%)* |
| Гипоэхогенные очаги | 14(35,9%) | 12(41,4%) |
| Лейкоцитурия | 15(38,5%) | 6 (20,7%) |
Результаты
Бактериологическое исследование биоптатов предстательной железы позволило выявить широкий спектр неклостридиально-анаэробных бактерий, среди которых преобладали пептококки, пропионибактерии, эубактерии, бактероиды, пептострептококки. Частота выделения большинства анаэробов была выше при ДГПЖ, исключение составляли лишь бактероиды, пептострептококки, вилонеллы и превотеллы. Причем частота выделения пептококков (24,1%), пропионибактерий (18,2%) и эубактерий (14,6%) достоверно выше при ДГПЖ в сравнении с РПЖ, где данные бактерии выделены в 16,3%, 13,3% и 9% случаев соответственно (р<0,05). Ни в одном из биоптатов при РПЖ не были выделены капноцитофаги. В то время как при РПЖ достоверно чаще встречались пептострептококки (15,1%) в сравнении с ДГПЖ, где частота их выделения равнялась 8,3% (р<0,05) (рис. 1).
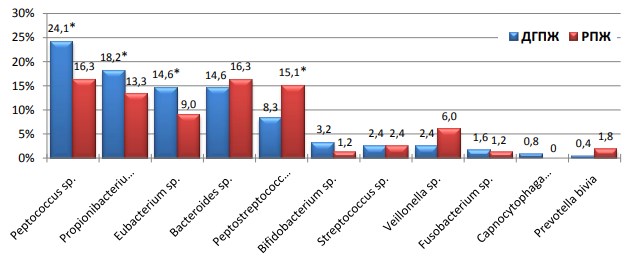
Рис. 1. Видовой спектр и частота выделения анаэробов при ДГПЖ и РПЖ
Спектр аэробов значительно уступал анаэробам и представлен 4 видами микробов. При РПЖ были выделены только 2 из них: это энтерококки (4,8%) и коринебактерии (1,2%), причем частота их выделения была выше в сравнении с ДГПЖ, где данные бактерии выделены в 1,3%, и 0,4% случаев соответственно, для энторококков различия имели статистическую значимость (р<0,05). Ни в одном из биоптатов при РПЖ не были выделены кишечные палочки и когулазоотрицательные стафилококки (рис. 2).
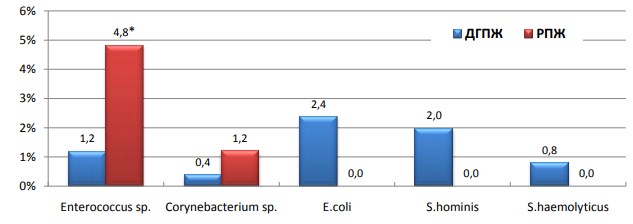
Рис. 2. Видовой спектр и частота выделения аэробов при ДГПЖ и РПЖ
Моноинфекция отмечена в 12,8% наблюдений ДГПЖ и 13,8% наблюдений РПЖ, во всех остальных случаях имела место микст-инфекция. Этиологический спектр микроорганизмов встречаемых в одной простате шире при ДГПЖ в сравнении с РПЖ (р<0,05). При РПЖ в большинстве случаев (86%) выделено 2-3 вида бактерий, а при ДГПЖ в одной простате могло быть обнаружено до 9-11 видов бактерий (рис. 3).
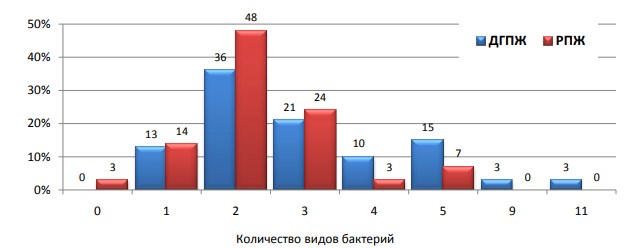
Рис. 3. Количество видов бактерий встречаемых у одного пациента при ДГПЖ и РПЖ
Анаэробы выделены в 92% биоптатов при ДГПЖ и в 87% при РПЖ. В то время как аэробы встречались в 6% случаев при ДГПЖ, и в 1,2% случаев при РПЖ. Таким образом, частота выявления анаэробов значительно выше, чем аэробов, как при РПЖ, так и при ДГПЖ (р<0,001). В свою очередь, в биоптатах с ДГПЖ в сравнении с РПЖ значительно чаще выделяются как аэробы, так и анаэробы (р<0,05) (рис.4).
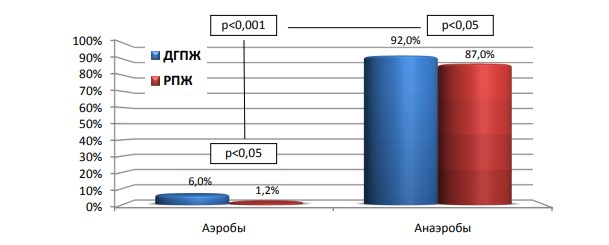
Рис. 4. Частота выделения анаэробов и аэробов при ДГПЖ и РПЖ
Максимальный уровень обсемененности биоптатов при ДГПЖ был определен для бактероидов (104 КОЕ/мл), стрептококков (103,5 КОЕ/мл), бифидобактерий (103,3 КОЕ/мл) и эубактерий (103,1 КОЕ/мл). При РПЖ наиболее высокий уровень обсемененности биоптатов установлен для превотелл (103,3 КОЕ/мл), стрептококков (102,7 КОЕ/мл), эубактерий (102,6 КОЕ/мл) и пептострептококков (102,6 КОЕ/мл). Достоверные различия по уровню обсемененности между группами получены для бактероидов и бифидобактерий, где при ДГПЖ их концентрация выше (р<0,05). В целом, практически все анаэробы имели более высокие значения уровня обсемененности биоптатов при ДГПЖ, исключение составляют только лишь превотеллы, степень обсемененности которых, при РПЖ в 3 раза выше, чем при ДГПЖ (р<0,05) (рис.5).

Рис. 5. Средний уровень обсемененности анаэробами (КОЕ/мл) при ДГПЖ и РПЖ
Степень обсемененности биоптатов аэробами при РПЖ также минимальна, для энтерококков она составила 101,1 КОЕ/мл, а для коринебактерий - 101,5 КОЕ/мл, в отличие от ДГПЖ, где степень обсемененности данными бактериями была выше более чем в два раза (р<0,05). При доброкачественной гиперплазии предстательной железы уровень обсемененности аэробами достаточно высок и составляет от 102,6 КОЕ/мл - энтерококки до 104 КОЕ/мл - коринобактерии (рис. 6).
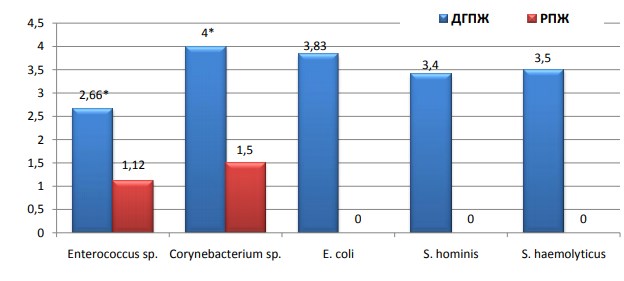
Рис. 6. Средний уровень обсемененности аэробами (КОЕ/мл) при ДГПЖ и РПЖ
Средний уровень обсемененности биоптатов предстательной железы при ДГПЖ составил 102,66±0,09 КОЕ/мл, при РПЖ 101,89±0,10 КОЕ/мл (р<0,001). При раке предстательной железы в 5 раз чаще, чем при ДГПЖ встречались стерильные биоптаты (р<0,001) (рис. 7).
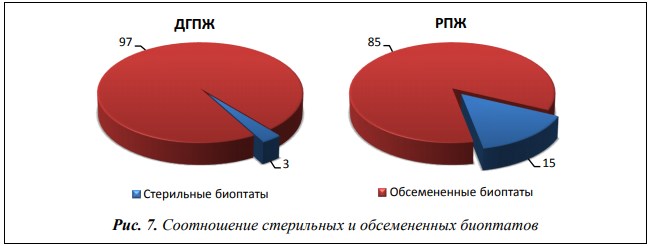
Рис. 7. Соотношение стерильных и обсемененных биоптатов
Анализ уровня инфицированности и микробиологического спектра периферической зоны простаты в сравнении с центральной зоной не выявил значимых различий, как при РПЖ, так и при ДГПЖ (р>0,05).
Обсуждение
В настоящее время, нет сомнений в том, что пусковым механизмом развития хронического бактериального простатита является инфекционный фактор, а доказанными и общепризнанными патогенами – грамотрицательные бактерии, преимущественно представители семейства Enterobacteriaceae, некоторые представители грампозитивной флоры, в частности, энтерококки, стафилококки [12].
В исследованиях последних лет, инфекционный фактор обсуждается также и в контексте генеза РПЖ. Так, в центре изучения рака Джона Хопкинса (Балтимор, США) проведен анализ основных клинических и эпидемиологических исследований о связи инфекционного фактора с простатоканцерогенезом. Отмечено, что воспаление часто присутствует в образцах ткани предстательной железы полученных при биопсии простаты, радикальной простатэктомии и трансуретральной резекции. Кроме того, воспалительные инфильтраты, часто оказываются вокруг очагов атрофии, которые характеризуются повышенной пролиферативной активностью. Эти фокусы пролиферативной воспалительной атрофии могут быть предшественниками ранних форм рака простаты. Исследования косвенно подтверждают роль хронического воспаления в инициации канцерогенеза путем изучения провоспалительных и противовоспалительных факторов, приводящих к повреждению клеток и мутациям ДНК [13].
Во многих работах, посвященных данной тематике, чаще констатируется факт выделения той или иной группы микроорганизмов при РПЖ, идет по крупицам накопление фактического материала. Изучены микробные ДНК в ткани предстательной железы, полученной методом промежностной биопсии простаты, у 9 пациентов с локальным РПЖ. Позитивными для бактериальной ДНК оказались 61% биоптатов, в т.ч. для кишечных палочек и бактероидов. Ранее было установлено наличие ДНК микроорганизмов в ткани простаты у 77% больных с абактериальным простатитом. Авторы заключили что, наличие бактериальных генов в простате не является специфическим для хронического простатита и имеет место у большинства больных с раком простаты [14]. Cohen R.J. с соавт. (университет Западной Австралии) провели культуральные исследования образцов ткани предстательной железы 34 пациентов после радикальной простатэктомии. Пропионибактерии оказались наиболее часто обнаруживаемыми в простатической ткани микроорганизмами – 35% случаев, и имели прямую корреляционную связь с выраженностью воспаления. Авторы пока лишь предполагают, что инициируемое данным микроорганизмом воспаление, может быть связано с развитием РПЖ [15].
По сути, с исследованиями Cohen R.J. корреспондирует работа, проведенная в университете Умео (Швеция) [16]. Авторы изучили бактериальные РНК в образцах простаты 352 больных оперированных по поводу ДГПЖ и оценили наличие бактериальных патогенов в группе пациентов, где в ходе последующего мониторирования был выявлен РПЖ (n=171) и в группе контроля, состоящей из пациентов с ДГПЖ (n=181). В образцах с РПЖ в 62% выявлены тяжелые гистологические воспалительные изменения по сравнению с 50% образцов с гиперплазией. Микробная РНК обнаружена в 73% образцах ткани простаты. Чаще у пациентов с РПЖ регистрировались пропионибактерии (23%) и кишечные палочки (12%). Данное исследование показало, что микробный спектр при РПЖ не имел значимых отличий от ДГПЖ, а пропионибактерии с одинаковой частотой встречается как при РПЖ, так и при ДГПЖ. В нашем исследовании получены несколько противоположные результаты. Бактериальная популяция при ДГПЖ превалировала в сравнении с РПЖ, как в качественном, так и в количественном отношении. Микробная обсемененность предстательной железы подтверждена во всех случаях ДГПЖ и в 96,6% случаев РПЖ. В таксономической структуре при РПЖ преобладали пептококки (16,3%), бактероиды (16,3%), пептострептококки (15,1%), пропионибактерии (13,3%). Не смотря на то, что пропионибактерии и отнесены к группе наиболее часто встречаемых микробов, частота их выявления достоверно выше при ДГПЖ (18,2% vs 13,3%). Кишечные палочки, а также коагулазоотрицательные стафилакокки при РПЖ не обнаружены вовсе.
Результаты исследования 170 биоптатов предстательной железы, полученных у 30 пациентов с РПЖ, приведены в работе Sfanos K.S. [17]. Использованы методики полимеразной цепной реакции (ПЦР), а так же классические микробиологические методики культивирования. ПЦРтипирование указало на наличие 83 различных микроорганизмов. При микробиологическом исследовании посредством стандартных методик посева было обнаружено значительно меньшее количество видов бактерий. В целом, у 87% пациентов выявлены ДНК инфекционных патогенов, однако большинство отдельных биоптатов (62%) были стерильны. Авторам не удалось выявить достоверной связи между наличием определенных видов бактерий и выраженностью воспаления, однако был сделан вывод о региональной неоднородности инфекционного поражения железы. Результаты нашего исследования, несмотря на значительно меньшее количество стерильных биоптатов, выявленных при РПЖ (15%), подтверждают данное заключение. Количество видов бактерий и уровень обсемененности биоптатов, полученных из одной предстательной железы варьировали. Сравнительный анализ микробного спектра периферической и центральной зон простаты значимых различий не выявил.
Выводы
Таким образом, проведенное исследование позволило определить достоверные отличия в видовом и количественном спектре микробного ансамбля при РПЖ и ДГПЖ. Доминирующими бактериями простаты как при ДГПЖ, так и при РПЖ являлись пептококки, пропионибактерии, эубактерии, бактероиды, пептострептококки. Средний уровень обсемененности биоптатов простаты и частота выделения различных видов бактерий при ДГПЖ превышают таковые в сравнении с РПЖ, причѐм некоторые бактерии при РПЖ не обнаруживаются вовсе и в большем проценте случаев встречаются стерильные биоптаты. Частота выделения неклостридиальных анаэробов значительно превалирует над аэробами, как при РПЖ, так и при ДГПЖ.
Исследованиями установлена бактериальная обсемененность простаты во всех случаях ДГПЖ и в 96,6% случаев РПЖ. Только в 12,8% наблюдений ДГПЖ и 13,8% наблюдений РПЖ имела место моноинфекция, во всех остальных случаях отмечена микстинфекция. Обнаруженные нами различия в бактериальном спектре простаты при ДГПЖ и РПЖ требует дальнейшего исследования, так как могут быть специфичными для каждого из этих поражений.
Литература
- Fibbi B., Penna G., Morelli A. et al. Chronic inflammation in the pathogenesis of benign prostatic hyperplasia // Int J Androl. – 2010. – Vol.33, №3. – P. 475- 488.
- Lucia M.S., Lambert J.R. Growth factors in benign prostatic hyperplasia: basic science implications // Curr Urol Rep. – 2008. – Vol.9, №4. – P. 272-278.
- Robert G., Descazeaud A., Nicolaïew N. et al. Inflammation in benign prostatic hyperplasia: a 282 patients' immunohistochemical analysis // Prostate. – 2009. – Vol.69, №16. – P. 1774-1780.
- Kwon Y.K., Choe M.S., Seo K.W. et al. The effect of intraprostatic chronic inflammation on benign prostatic hyperplasia treatment // Korean J Urol. – 2010. – Vol.51, №4. – P. 266-270.
- Sciarra A., Di Silverio F., Salciccia S. et al. Inflammation and chronic prostatic diseases: evidence for a link? // Eur Urol. – 2007. – Vol.52., №4. – P. 964-972.
- Sciarra A., Mariotti G., Salciccia S. et al. Prostate growth and inflammation. // J Steroid Biochem Mol Biol. – 2008. – Vol.108, №3-5. – P. 254-60.
- Аляев Ю.Г., Винаров А.З., Фиев Д.Н. и соавт. Возможно ли влияние микоплазменной инфекции на патогенез рака предстательной железы // Онкоурология. – 2010. – №1. – С. 28-32.
- Sugar L.M. Inflammation and prostate cancer // Can J Urol. – 2006. – Feb., Vol.13, Suppl.1. – P. 46-47.
- Palapattu G.S., Sutcliffe S., Bastian P.J. et al. Prostate carcinogenesis and inflammation: emerging insights // Carcinogenesis. – 2005. – Vol. 26, №7. – P. 1170-1181.
- Bastian P.J., Nuhn P., Stadler T.C. et al. Prostatic inflammation and prostate cancer // Urologe A. – 2010. – Vol.49, №5. – P. 636-638.
- Namiki K., Goodison S., Porvasnik S. et аl. Persistent Exposure to Mycoplasma Induces Malignant Transformation of Human Prostate Cells // PLoS One. – 2009. – Vol.4, №9. – P. 68-72.
- Набока Ю.Л., Коган М.И., Гудима И.А. и соавт. Особенности этиологической структуры и факторов персистенции бактерий, выделенных при инфекции нижних мочевых путей и хроническом бактериальном простатите // Микробиология. – 2012. – №5. – С. 8-12.
- Platz E.A., De Marzo A.M. Epidemiology of Inflammation and Prostate Cancer // J Urol. – 2004. – Vol.171, №2. – P. 36-40.
- Keay S., Zhang C.O., Baldwin B.R. et al. Polymerase chain reaction amplification of bacterial 16s rRNA genes in prostate biopsies from men without chronic prostatitis // Urology. – 1999. – Vol.53, №3 – P. 487-491.
- Cohen R.J., Shannon B.A., McNeal J.E. et al. Propionibacterium acnes associated with inflammation in radical prostatectomy specimens: a possible link to cancer evolution? // J Urol. – 2005. – Vol.173, №6. – P. 1969- 1974.
- Alexeyev O., Bergh J., Marklund I. et al. Association between the presence of bacterial 16S RNA in prostate specimens taken during transurethral resection of prostate and subsequent risk of prostate cancer (Sweden) // Cancer Causes Control. – 2006. – Vol.17, №9. – P. 1127-1133.
- Sfanos K.S., Sauvageot J., Fedor H.L. et al. A molecular analysis of prokaryotic and viral DNA sequences in prostate tissue from patients with prostate cancer indicates the presence of multiple and diverse microorganisms // Prostate. – 2008. – Vol.68, №3. – P. 306-320.
Статья опубликована в журнале "Вестник урологии". Номер №1/2013 стр. 28-38