И.С. Шорманов1, М.С. Лось2, Н.С. Шорманова1
1ФГБОУ ВО «Ярославский государственный медицинский университет» Минздрава РФ
2ГБУЗ Ярославской области «Областная клиническая больница»
На сегодняшний день в России на долю рака почки в общей структуре заболеваемости злокачественными новообразованиями приходится 3,9%. Ему отводится 10-е место среди всех злокачественных опухолей. На протяжении последних десятилетий мировая статистика отмечает рост выявления опухолей почек. Так, в нашей стране в 2013 г. рак почки впервые был диагностирован у 20 892 пациентов, а в 2014 г. – у 22 234. При этом смертность от данной патологии в 2013 г. составила 8 459 больных, в 2014 г. – 8 430 [1,2]. Радикальным лечением рака почки является его хирургическое удаление. Но и нефрэктомия и резекция почки в отдаленном периоде могут приводить к ухудшению почечной функции [3,4]. Потеря почечной функции может снизить продолжительность жизни, увеличивая риск развития сердечно-сосудистых заболеваний и их летальных осложнений [4,5,6].
В связи с изложенным, в последние годы ведется активный поиск средств для защиты почечной функции и улучшения качества жизни [3,6-8]. Время «тепловой ишемии», создаваемой для «сухого» операционного поля, является основным провоцирующим фактором почечного повреждения. Доказано, что пережатие почечных сосудов более 20 минут, приводит к повреждениям необратимого характера и склерозу почечной ткани [9,10]. Некоторые авторы для создания «сухого» поля рекомендуют только пережатие паренхимы в месте резекции или наложение превентивных швов [11,12]. Но сама по себе резекция почки скальпелем с последующим ушиванием раны характеризуется образованием широкой зоны краевого некроза ткани с нагноением, длительностью процесса заживления раны более 4-5 недель с развитием грубого рубца, вызывающего деформацию и атрофию почечной паренхимы [13]. Катехоламины, серотонин, гистамин, кинины, поступающие из очага ишемического повреждения, играют важную роль в возникновении первичных микроциркуляторных и реологических расстройств в почечной паренхиме и запускают воспалительный ответ и нарушения системной гемодинамики [14-17]. С клинической точки зрения, для коррекции происходящих нарушений, которые могут ухудшать функцию нефронов как в ближайшие, так и в отдаленные сроки после оперативного лечения, необходимо проведение противовоспалительных, стимулирующих репарацию мероприятий.
Цель исследования: изучить взаимосвязь патоморфологических изменений почечной ткани в раннем послеоперационном периоде органосохраняющих операций на почках с активностью кортико-симпато-адреналовой системы в эксперименте.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперимент выполнен на 40 белых лабораторных крысах весом от 200 до 300 г. С лабораторными животными работали в соответствии с действующими «Правилами проведения работ с использованием экспериментальных животных» и «Международными рекомендациями по проведению медико-биологических исследований с использованием животных». 10 крыс были определены в группу интактного контроля, 30 – прооперированы, им выполнена резекция нижнего полюса левой почки. «Сухое» поле создавалось путем пальцевого сдавления края резекции, окончательный гемостаз выполнялся с помощью наложения Z-образных швов нитью ПГА 4/0 с атравматичной иглой на зону резекции. В послеоперационном периоде на 7-е, 14-е и 28-е сутки (n=10) животным выполнялось патогистологическое исследование почек и биохимический анализ для определения содержания адреналина, норадреналина, серотонина, гистамина, дофамина в крови и оперированной почке, а так же креатинина и 11-ОКС в крови. Выведение крыс из опыта проводили с соблюдением «Правил проведения работ с использованием экспериментальных животных» и правилами, изложенными в Хельсинской декларации.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В таблицах 1 и 2 представлены показатели кортико-симпато-адреналовой системы крови и ткани почки у неоперированных животных, принятые за референсные значения, и на различные сроки после резекции почки.
Таблица 1. Уровень сосудосуживающих показателей кортико-симпатоадреналовой системы лабораторных животных контрольной группы и на разные сроки после резекции почки
| материал | адреналин | норадреналин | 11-ОКС | серотонин |
| Контрольная группа | ||||
| Кровь, (мкг/мл) | 0,094 ± 0,007 | 0,114 ± 0,008 | 0,65 ± 0,06 | 0,068 ± 0,003 |
| Почка, (мкг/г) | 0,562 ± 0,052 | 3,186 ± 0,198 | 0,418 ± 0,032 | |
| Через 7 дней после резекции почки, (n=10) | ||||
| Кровь, (мкг/мл) | 0,118 ± 0,015 | 0,135 ± 0,010 | 0,98 ± 0,11* | 0,137± 0,010* |
| Почка, (мкг/г) | 0,788 ± 0,084* | 3,764 ± 0,194* | 0,633 ± 0,055* | |
| Через 14 дней после резекции почки, (n=10) | ||||
| Кровь, (мкг/мл) | 0,055 ± 0,009* | 0,162 ± 0,011* | 0,86 ± 0,10 | 0,184 ± 0,013* |
| Почка, (мкг/г) | 0,321 ± 0,039* | 4,077 ± 0,232* | 0,750 ± 0,061* | |
| Через 28 дней после резекции почки, (n=10) | ||||
| Кровь, (мкг/мл) | 0,080 ± 0,006 | 0,122 ± 0,014 | 1,18 ± 0,12* | 0,109 ± 0,004* |
| Почка, (мкг/г) | 0,540 ± 0,033 | 3,433 ± 0,230 | 0,580 ± 0,052* | |
* достоверная разница (p<0,05) между опытными и интактными животными.
Таблица 2. Уровень сосудорасширяющих показателей кортико-симпатоадреналовой системы лабораторных животных контрольной группы и на разные сроки после резекции почки
| материал | дофамин | Гистамин |
| Контрольная группа | ||
| Кровь, (мкг/мл) | 0,111± 0,007 | 0,102 ± 0,003 |
| Почка, (мкг/г) | 1,230 ± 0,126 | 0,502 ± 0,045 |
| Через 7 дней после резекции почки | ||
| Кровь, (мкг/мл) | 0,068± 0,011* | 0,137± 0,011* |
| Почка, (мкг/г) | 0,408 ± 0,049* | 0,901± 0,088* |
| Через 14 дней после резекции почки, (n=10) | ||
| Кровь, (мкг/мл) | 0,055± 0,008* | 0,184± 0,013* |
| Почка, (мкг/г) | 0,653 ± 0,075* | 1,100± 0,132* |
| Через 28 дней после резекции почки, (n=10) | ||
| Кровь, (мкг/мл) | 0,082± 0,006* | 0,109± 0,004 |
| Почка, (мкг/г) | 0,780 ± 0,099* | 0,736± 0,077* |
*достоверная разница (p<0,05) между опытными и интактными животными
На 7-е сутки после резекции в паранефральной клетчатке и под соединительнотканной капсулой этих органов были выявлены множественные кровоизлияния темно-красного цвета. Они имели различную величину и форму, а местами носили сливной характер. Почки представлялись уменьшенными в вертикальном размере, а полюс, соответствующий области резекции, утрачивал овальный вид и ровный контур. Ткань его на разрезе имела белесовато-серый цвет, в ней просматривались нити шовного материала. Гистологическое исследование показало, что в месте оперативного вмешательства определяется широкая зона некроза всех тканевых компонентов почки: клубочков, стенок канальцев (эпителий и базальная мембрана), стромы и сосудов микроциркуляции (рис. 1 а,б,в). При этом клетки соответствующих структур утрачивали ядра, цитоплазма их становилась мутной, а сами они приобретали зернистый вид и однородный розовый цвет (рис. 1 а,б,в). Наружные отделы области некроза нередко подвергались геморрагической инфильтрации (рис.1 б,в). Часто кровоизлияния выявлялись также в капиллярных петлях погибших клубочков (рис. 1 а) и в строме между канальцами (рис. 1 в). Иногда эти компоненты ренальной ткани утрачивали свои контуры и сливались в однородный эозинофильный детрит, в котором встречались редкие клетки белой крови. Граница между некротизированной и сохранной почечной тканью маркировалась скоплениями преимущественно полинуклеарных и редких мононуклеарных лейкоцитов. В этой области не было признаков фибриллогенеза.
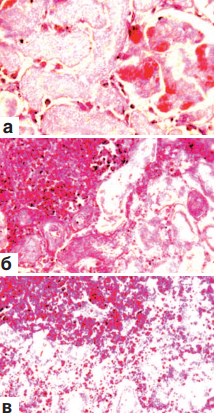
Рис. 1. Состояние ткани почки в зоне резекции, срок наблюдения 7 суток. Окраска гематоксилином и эозином.
а. Некроз всех тканевых компонентов почки. Геморрагии в капиллярных петлях почечного клубочка. х200.
б. Геморрагическая инфильтрация наружных отделов области некроза. х200. в. Геморрагическая инфильтрация наружных отделов области некроза. Кровоизлияния в строме погибшей почечной ткани. х200
В ряде наблюдений в этот срок опыта в жировой капсуле почек или на их территории среди некротизированной или примыкавшей к ней жизнеспособной ткани обнаруживались микроабсцессы. Эти образования представляли собой небольшие полости гнойного расплавления, заполненные погибшими или погибающими сегментоядерными лейкоцитами (рис. 2 а,б,в). В одних случаях ткань вокруг них была пропитана кровью (рис. 2 а), в других – геморрагический выпот отсутствовал (рис. 2 б,в). Важно отметить, что в этот срок эксперимента никакой линии демаркации, отграничивающей описываемые гнойнички от окружающих структур почки, не регистрировалось (рисунок 2 а,б,в).
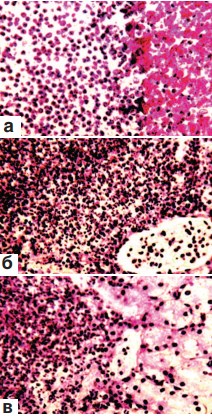
Рис. 2. Состояние ткани почки в зоне резекции. Срок наблюдения 7 суток. Окраска гематоксилином и эозином.
а. Микроабсцесс в некротизированной области почки; ткань вокруг него пропитана кровью. х200.
б, в. Микроабсцесс граничит с дистрофически измененной, но жизнеспособной тканью почки. Геморрагическая инфильтрация вокруг него отсутствует. х200
В корковом и мозговом слоях почек вне зоны оперативного вмешательства констатировались признаки резко выраженного полнокровия и отека стромы (рис. 3 а), а также гиперемия капиллярных петель гломерул. Многие артерии находились в состоянии дистонии (рис. 3 б). Повсеместно выявлялись кровоизлияния различной величины. В одних случаях это были микрогематомы (рис. 3 в), в других – геморрагическая инфильтрация ткани. Часто скопления эритроцитов обнаруживались в боуменовых капсулах мальпигиевых телец, а также в просвете почечных канальцев различного вида и в собирательных трубочках. В почечных чашечках находились эритроциты, нейтрофильные лейкоциты и десквамированные клетки покровного переходного эпителия (рис. 4 а,б). Форменные элементы крови встречались и на различных уровнях канальцевого аппарата нефрона. Извитые канальца коркового слоя, прямые канальцы мозгового вещества почек и собирательные трубочки представлялись расширенными. В выстилающем их эпителии визуализировались признаки гидропической дистрофии (рис. 3 в; 4 б). В эпителии канальцев содержание гликогена было резко снижено (рис. 4 в).
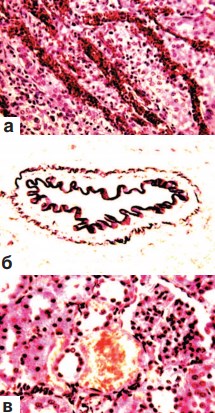
Рис. 3. Состояние ткани почки выше зоны резекции. Срок наблюдения 7 суток.
а. Резкое полнокровие и отек стромы мозгового слоя. Окраска гематоксилином и эозином. х200.
б. Дистония артерии среднего калибра корковой зоны. Окраска по Харту. х200. в. Кровоизлияния в строму. Гидропическая дистрофия эпителия извитых канальцев.Окраска гематоксилином и эозином. х200
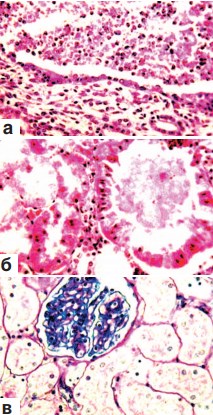
Рис. 4. Состояние ткани почки выше зоны резекции. Срок наблюдения 7 суток.
а. Наличие в просвете чашечек эритроцитов, нейтрофильных лейкоцитов и десквамированных клеток переходного эпителия. х200.
б. Гидропическая дистрофия и некроз эпителия извитых канальцев и собирательной трубочки. Наличие в просвете тубулярных структур зернистых цилиндров. Лейкоцитарная инфильтрация стромы. х200.
в. Резкое снижение содержания гликогена в эпителии канальцев. х200. а,б – окраска гематоксилином и эозином; в – ШИК-реакция.
В крови лабораторных животных на 7-е сутки после операции уровень сосудосуживающих биохимических агентов был значимо повышен: адреналина на 26%, глюкокортикоидов на 51 %, серотонина в 2 раза (p<0,05). Повышение норадреналина не было статистически достоверным и составило 18% от контрольных значений. В почках увеличение адреналина составило 40%, норадреналина – 18%, серотонина – в 1,5 раза (p<0,05). Уровень дофамина, как основного сосудорасширяющего фактора, в крови снизился на 39%, в почках – в 3 раза (p<0,05). Уровень гистамина, отвечающего не только за вазодилятацию, но и за воспалительный ответ, в крови и почках достоверно нарастал на 43 и 79%, соответственно (табл. 1,2).
Макроскопическое исследование почек на 14-е сутки эксперимента показало, что в окружающей их жировой клетчатке и под капсулой просматриваются различной величины кровоизлияния, одни из которых имели темно-красный, а другие буро-коричневый цвет. По своим размерам, форме и виду на разрезе почки не отличались от таковых в предыдущий срок наблюдения. Микроскопическое изучение материала позволило установить, что так же, как и на 7-е сутки опыта, в месте резекции почек располагается широкая область тотального некроза ткани, переходящая в более глубоких отделах исследуемого органа в зону геморрагической инфильтрации. На границе с жизнеспособной почечной тканью располагались не только нейтрофильные инфильтраты, но и большое количество мононуклеаров, а также молодых фибробластов. Вместе с тем просматривались признаки нарастающего фибриллогенеза с началом формирования вала демаркации. Вокруг микроабсцессов, локализующихся в поврежденной почечной ткани и паранефральной клетчатке, также отмечалось появление полинуклеарного инфильтрата, кнаружи от которого располагался слой фибробластов, перемежающихся с капиллярами и фибриллярными структурами. Выше места резекции нижнего полюса почек в ткани их отмечался отек, полнокровие микроциркуляторного кровеносного русла, а также мелких артерий и вен. В строме коркового и мозгового слоев органов, под их фиброзной капсулой встречались кровоизлияния. На границе некоторых из них с окружающими тканями прослеживалась воспалительная реакция с захватом макрофагами эритроцитов и образованием бурого пигмента гемосидерина. Изредка небольшие скопления крови обнаруживались в боуменовых капсулах гломерул и просвете канальцев нефрона. Канальцы коркового вещества почек были расширены, иногда содержали зернистые цилиндры. Клетки эпителия данных структур характеризовались зернистой, реже гидропической дистрофией, а иногда и некрозом. Концентрация гликогена в них была низкой. В окружающей канальцы строме располагались очаговые и диффузные лейкоцитарные инфильтраты, представленные нейтрофилами, лимфоцитами и макрофагами с глыбками гемосидерина между ними.
На 14-е сутки исследования показатели адреналина резко снижались – в крови на 53% (p<0,05), (на 41% ниже контроля), а в почках – на 59% (p<0,05), (на 43% ниже контроля). Уровень норадреналина возрастал в крови на 42%, в почках – на 30% (p<0,05). Содержание 11-ОКС к 14 дню снизилось на 12%, с сохранением высоких показателей (на 32% относительно контрольного уровня) (p<0,05). Концентрация серотонина в крови превышала нормальные значения 2,7 раза, в почках – в 1,8 раза (p<0,05). Уровень гистамина был выше уровня контрольных значений на 80% в крови и на 119% в почках. Уровень дофамина, по отношению к значениям 7-го дня после операции, в крови продолжал снижаться (19 %) и к 14-му дню был ниже контрольных значений на 50%. В почках произошло повышение изучаемого показателя на 60%, но он оставался ниже нормы в 1,9 раза (табл. 1,2).
На 28-е сутки после произведенной резекции почки были окружены уплотненной белесоватой жировой клетчаткой в которой так же, как и в соединительнотканной почечной капсуле, обнаруживались участки бурого цвета различной величины и формы. Почки представлялись уплотненными, особенно в области нижнего полюса. На разрезе эта их часть имела неровный внешний контур и выглядела белесовато-серой. Гистологическим исследованием выявлен активный процесс врастания грануляций в зону оперативного вмешательства (рис. 5 а,б,в). В одних участках они окружали сохранившиеся поврежденные ткани почки (рис. 5 а,б,в), в других – отмечалась полная резорбция некротических масс и замещение их молодой отечной соединительной тканью. Последняя была представлена сосудами и рыхло расположенными тонкими коллагеновыми, ретикулиновыми и эластическими волокнами (рис. 5 а,в). Среди клеток и перечисленных волокнистых структур определялись скопления пигмента гемосидерина (рис. 5 а). Содержание гликогена в канальцевом эпителии было хотя и пониженным, но существенно выше, чем в предыдущие сроки эксперимента. Образовавшиеся ранее микроабсцессы окружались грануляционной тканью и подвергались рассасыванию, хотя этот процесс не всегда доходил до завершения (рис. 6 а,б,в). В отделах оперированных почек, расположенных выше места их резекции, отмечался некоторый отек межуточной ткани, незначительная инфильтрация ее мононуклеарами, умеренное полнокровие сосудов стромы и капиллярных петель клубочков. Ранее возникшие кровоизлияния подвергались рассасыванию и частично или полностью прорастали соединительной тканью (рис. 7 а). Извитые канальцы представлялись умеренно расширенными с признаками зернистой, редко гидропической дистрофии (рис. 7 б,в). Некротических изменений канальцевого эпителия не было. На этом фоне встречались канальцы, выстланные крупными клетками с яркой однородной цитоплазмой и иногда двумя ядрами (рис. 7 в).
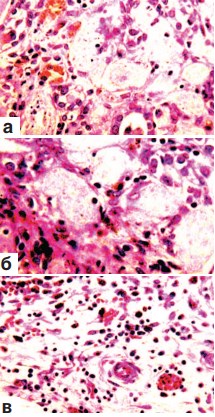
Рис. 5. Состояние ткани почки в зоне резекции. Срок наблюдения 28 суток. Окраска гематоксилином и эозином. а,б. Врастание грануляций в зону некроза. Наличие среди грануляционной ткани скоплений гемосидерина. х400. в. Замещение зоны некроза рыхлой отечной грануляционной тканью, богатой сосудами и тонкими фибриллами. Наличие среди грануляций скоплений гемосидерина. х200
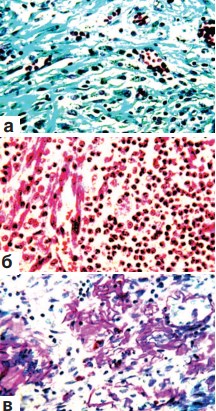
Рис. 6. Состояние ткани почки в зоне резекции. Срок наблюдения 28 суток. х200. а. Рыхло расположенные тонкие коллагеновые волокна в области замещения зоны некроза грануляциями. Окраска по Массону. б. Инкапсуляция и организация микроабсцесса. Окраска гематоксилином и эозином. в. Переплетающиеся ретикулиновые волокна в области разрастающихся грануляций. ШИК-реакция
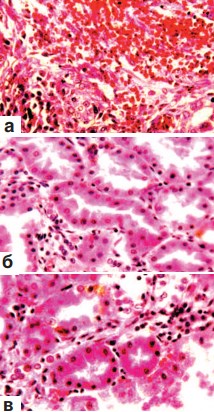
Рис. 7. Состояние ткани почки выше зоны резекции. Срок наблюдения 28 суток. Окраска гематоксилином и эозином.
а. Инкапсуляция и прорастание незрелой соединительной тканью микрогематомы с рассасыванием элементов крови. х200.
б. Зернистая дистрофия эпителия извитых канальцев. х200.
в. Наличие в некоторых канальцах эпителиальной выстилки из крупных клеток с яркой однородной цитоплазмой. х400
К 28-му дню эксперимента происходила нормализация содержания адреналина и норадреналина как в крови, так и в почках. Уровень 11-ОКС вновь повышался на 82% от исходного (p<0,05). Содержание серотонина как в крови, так и в оперированной почке снижалось, но показатель оставался выше контрольного в крови – в 1,6 раза (p<0,05), в почках – в 1,4 раза. Концентрация гистамина в крови снизилась и достигла нормальных значений, а в почках данный показатель оставался на 47% выше контрольного (p<0,05). Уровень дофамина в крови, по отношению к предыдущему уровню повышался на 26%, но достоверно не достигал исходного уровня. В почках показатель так же не достиг дооперационного уровня и оставался ниже контрольного на 37% (p<0,05).
Колебания уровня креатинина крови на протяжении всего эксперимента находились в пределах нормальных значений и являлись статистически недостоверными (табл.1,2).
ОБСУЖДЕНИЕ
Исследование позволило выявить коррелирующую динамику патоморфологических и биохимических изменений в ответ на органосохраняющее оперативное лечение. Резекция нижнего полюса левой почки, при сохранном контралатеральном органе, привела к гормонально-медиаторному дисбалансу, который проявился нарастанием сосудосуживающих моноаминов (адреналина, норадреналина, серотонина) и потенцирующих их действие 11-ОКС и падением вазодилятирующих (дофамин). При этом показатели креатинина крови, привычного маркера функции почек в повседневной практике, оказались мало чувствительны к проведенной операции и не отличались от значений крови интактных крыс, что, по нашему мнению, связано с достаточной суммарной функцией почек.
Полное восстановление к 28-му дню эксперимента произошло только с показателями адреналина и норадреналина, как гормонов, выполняющих первичный, экстренный ответ на стрессовую ситуацию. Уровень дофамина, как основного вазодилятирующего агента, не нормализовался к этому сроку ни в крови, ни в почках. Первый пик повышения уровня глюкокортикоидов является ответом на операционный стресс, второй пик повышения в конце эксперимента, по-видимому, связан с инициацией репаративных и регенераторных процессов в прооперированной почке, так как для паренхиматозных органов глюкокортикоиды являются гормонами-анаболиками и инициируют белковый синтез. Содержание серотонина, как сосудосуживающего маркера и маркера, характеризующего воспалительный ответ, через месяц после операции не приходило в норму ни в крови, ни в оперированной почке. Несмотря на то, что уровень гистамина к окончанию эксперимента нормализовывался в крови, в почке его содержание достоверно превышало нормальные значения. Данная биохимическая ситуация говорит о том, что, несмотря на активность регенераторных процессов, к 28-м суткам после операции в паренхиме оперированного органа сохраняются вазоконстрикция мелких сосудов и воспалительный процесс зоны резекции. Этому соответствует патоморфологическая картина незавершенности репаративных процессов в зоне резекции после органосохраняющей операции на почке.
ВЫВОДЫ
С учетом отсутствия нормализации большинства биохимических показателей и патоморфологической картины незавершенности процесса заживления паренхимы почки через месяц после органосохраняющей операции, с целью сокращения сроков репарации и максимального сохранения функции резецированной почки показана коррекционная терапия, направленная на снижение активности воспалительных реакций и улучшение гемодинамики.
ЛИТЕРАТУРА
- Мурадян А. Г., Воробьев Н. В., Костин А. А., Толкачев А.О., Волченко Н. Н., Попов С.В., Мамонтова И. С. и др. Лапароскопическая резекция подковообразной почки по поводу почечно-клеточного рака. Вестник РГМУ 2016;(2): 55-59.
- Ивахно К. Ю., Киприянов Е. А., Важенин А. В., Карнаух П. А. Результаты органосохраняющего лечения пациентов с локализованным почечно-клеточным раком по оригинальной методике. Онкоурология 2017;13(2):36-42. DOI: 10.17650/172697762017132-36-42
- Jonasch E, Gao J, Rathmell WK. Renal cell carcinoma. BMJ 2014;349:4797. doi: 10.1136/bmj.g4797
- Derweesh IH. Bone health and chronic kidney disease: anotherreason for partial nephrectomy? Curr Opin Urol 2014;24(6):629-632.
- Шаповалов В. В.,КычаковА. А.,Яблонский В. А. Отдаленные результатыорганосохраняющего лечения рака почки. Материалы XIII конгресса Российского общества урологов. – М. – 6-8 ноября, 2013. – С. 381.
- Протощак В.В.,ШестаевА.Ю., ГулькоА.М. История развития хирургии новообразований почек. МатериалыXIII конгресса Российского общества урологов. – М. – 6-8 ноября, 2013. – С. 365-366.
- Motzer RJ,Agarwa l N,Beard C,Bolger G B ,Boston B,Carducci M A,NCCN clinical practice guidelines in oncology: kidney сancer. Natl Canc Netw. 2009;7(6):618-30.
- Лоран О.Б., Серегин А. В, Шустицкий Н. А. Опухоль почки – возможности органосохраняющих операций. Материалы XIII конгресса Российского общества урологов. – М. – 6-8 ноября, 2013. – С. 359-360.
- Волкова М. И., Матвеев В. Б., Скворцов И. Я. Функциональные результаты резекции почки при опухолевом поражении почечной паренхимы. Материалы VII конгресса Российского общества онкоурологов. – М. – 3-5 октября, 2012. – С. 145 – 146.
- Thompson RH1, Frank I, Lohse CM, Saad IR, Fergany A, Zincke H, et al. The impact of ischemia time during open nephron sparing surgery on solitary kidneys: a multi-institutional study. J Urol 2007;177(2):471-476. doi: 10.1016/ j.juro.2006.09.036
- Мосоян М.С., Аль-Шукри С.Х., Ильин Д.М., Корза С.В. Первый опыт применения нового зажима для селективного пережатия почечной паренхимыв ходе открытой резекции почки.Дальневосточный медицинский журнал 2013;(2):89-91
- Серегин А.В., Шустицкий Н.А., Индароков Т.Р., Серегин А.А., Морозов А.Д., Мулабаев А.К. Протективная резекция почки при почечно-клеточном раке. Экспериментальная и клиническая урология 2016;(3):32-35
- Эфендиев Н.Л. Резекция почки. Баку: Азернешр, 1979. 203 с.
- Boero R, Pignataro A, Ferro M, Quarello F. Symparhetic nervous system and chronic renal failure. Clin Exper Hypertens 2001;23(1-2):69-75.
- Pilote L1,Abrahamowicz M, Eisenberg M, HumphriesK, Behlouli H, Tu JV. Effect of different angiotensin-converting-enzyme inhibitors on mortality among elderly patients with congestive heart failure. CMAJ 2008;178(10):1303-11. doi: 10.1503/cmaj.060068.
- Николаева А.А., Королева С.В., Ашмарин И.П. Дофамин – серотонин — соматостатин: изучение взаимодействий в этой системе обещает новые перспективы в теории и практике. Экспериментальная и клиническая фармакология 2009;( 2): 60–64.
- Бизунок Н.А. Биогенные амины – эндогенные модуляторы клеточной генерации aктивных форм кислорода. Белорусский медицинский журнал 2004; 4(10):11-8.
Статья опубликована в журнале"Экспериментальная и клиническая урология" №2 2018, стр. 12-19