В.А. Перепечай1, О.Н. Васильев2
1Д.м.н., врач-уролог высшей категории, доцент кафедры урологии и репродуктивного здоровья человека с курсом детской урологии-андрологии ФПК и ППС ФГБОУ ВО РостГМУ Минздрава России; руководитель Центра урологии, заведующий урологическим отделением РКБ ФГБУЗ ЮОМЦ ФМБА России
2К.м.н., ассистент кафедры урологии и репродуктивного здоровья человека с курсом детской урологии-андрологии ФПК и ППС ФГБОУ ВО РостГМУ Минздрава России
Лапароскопическая (в том числе роботическая) радикальная простатэктомия стала альтернативой открытой хирургии. Основные хирургические приемы сокращения периода недержания мочи после радикальной простатэктомии заключаются в сохранении, реконструкции и усилении структур, обеспечивающих сложный механизм удержания мочи – пубо-простато-пузырных связок, шейки мочевого пузыря, фасции Denonvilliers, в обеспечении функциональной длины уретры и пр.
Несмотря на достигнутые успехи в изучении механизма удержания мочи, полная ясность в данном вопросе пока не достигнута. В связи с этим продолжается поиск решений для максимально раннего удержания мочи, которое является одной из основных задач в социальной и медицинской реабилитации пациента, перенесшего радикальную простатэктомию. В статье рассмотрены основные современные приемы и техники выполнения радикальной лапароскопической простатэктомии для достижения максимально раннего восстановления континенции.
История
Лапароскопическая радикальная простатэктомия (ЛРПЭ) впервые была выполнена Schuessler et al. в 1991 году. [1]. На этом этапе операция не получила широкого распространения ввиду изначальной сложности техники ее выполнения. В 1997 году теми же авторами на 9 больных, сделан вывод о том, что лапароскопический подход не является альтернативой открытой операции в лечении локализованного рака простаты, из-за длительного времени операции и технической сложности [2]. Вслед за этим, Rabboy et al. [3] выполнили экстраперитонеальную лапароскопическую радикальную простатэктомию двум больным. В 1993 году Kavoussi et al. [4] описали лапароскопический доступ к семенным пузырькам при выполнении промежностной радикальной простатэктомии.
В 1997 году Gaston модифицировал лапароскопический доступ к семенным пузырькам [5]. Используя эту модификацию, Guillonneau и Vallancien в 1998 году описали технику трансперитонеальной антеградной ЛРПЭ, в последующем названной техникой «Montsouris», на 40 больных [6]. После чего другой парижский центр «Creteil» доложил о выполнении ЛРПЭ, используя технику подобную технике Montsouris. Далее оба этих центра показали одинаковое время этой операции ~ 3-4 часа после накопления достаточного опыта [7, 8]. В 1999 году Rassweiler et al. разработали технику ретроградной ЛРПЭ, повторяющую этапы открытой радикальной простатэктомии, которая названа «техникой Heilbronn» [9].
В 2001 году Bollens et al. [10] стандартизировали технику экстраперитонеальной ЛРПЭ, основываясь на своем опыте выполнения данной операции трансперитонеальным доступом. По мере накопления опыта лапароскопическая радикальная простатэктомия стала альтернативой открытой хирургии [5]. Основные хирургические приемы сокращения периода недержания мочи после РПЭ заключаются в сохранении, реконструкции и усилении структур, обеспечивающих сложный механизм удержания мочи – пубо-простато-пузырных связок, шейки мочевого пузыря, фасции Denonvilliers, в обеспечении функциональной длины уретры и пр.
По мере накопления клинического опыта специалисты пришли к выводу о необходимости выполнения так называемой суспензии уретроцистонеоанастомоза для обеспечения стабильности последнего в малом тазу, что по современным представлениям обусловливает более раннее восстановление континенции. Методики суспензии предусматривают стабилизацию уретроцистонеоанастомоза по передней, по задним полуокружностям, или же сочетание обоих подходов. Несмотря на достигнутые в течение 10-15 предшествующих лет успехи в изучении структур, участвующих в механизме удержания мочи, полная ясность в данном вопросе пока не достигнута. В связи с этим продолжается поиск решений для максимально раннего удержания мочи, которое является одной из основных задач в социальной и медицинской реабилитации пациента, перенесшего радикальную простатэктомию.
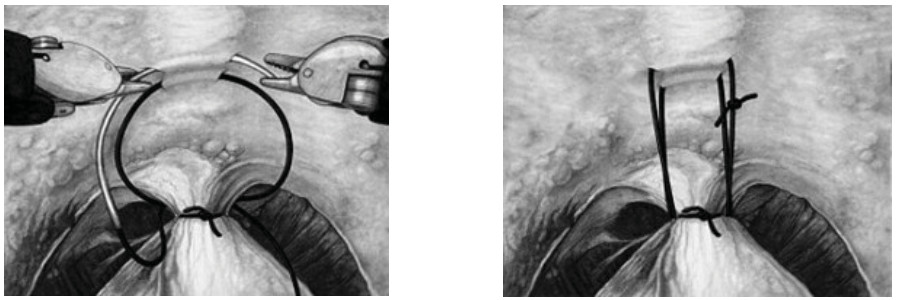
Рисунок 1. Методика передней суспензии уретроцистонеоанастомоза по V. Patel.
Figure 1. Method of anterior suspension of urethrocystoneoanastomosis according to V. Patel.
В 2009 году оригинальную методику передней суспензии при выполнении робот-ассистированной простатэктомии предложили V. Patel et al. [11]. После вскрытия эндопельвикальной фасции, лигирования дорзального венозного комплекса с сохранением пубо-простато-пузырных связок выполняется фиксация последних к надкостнице задней поверхности лона с формированием узла умеренной степени натяжения (рис. 1). Задняя суспензия, описанная F. Rocco et al. в 2006 году [12], заключается в восстановлении фасции Denonvilliers путем сшивания последней конец в конец (рис. 2).
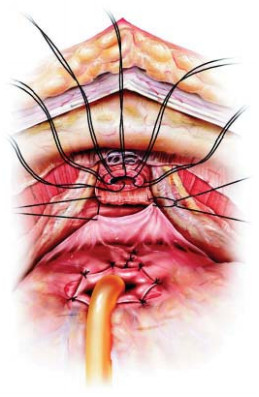
Рисунок 2. Методика задней суспензии уретроцистонеоанастомоза по F. Rocco.
Figure 2. Method of posterior suspension of urethrocystoneoanastomosis according to F. Rocco.
При выполнении ЛРПЭ, для сохранения континетности, так же необходимо максимально сохранять функциональную длину уретры за счёт выполнения ретракции предстательной железы в процессе апикальной диссекции. Совершенствование техники радикальной простатэктомии происходит соответственно эволюции изучения анатомии этой области, более точного понимания особенностей расположения и строения фасциальных слоев и функционально важных анатомических структур. Menon et al. описали свой опыт выполнения робот-ассистированной простатэктомии и предположили, что нервно-сосудистые пучки заключены в треугольный туннель, сформированный из двух слоев перипростатической фасции.
Они установили, что при выполнении нервсберегающей техники, перипростатическая фасция должна рассекаться по передней поверхности простаты параллельно нервно-сосудистым пучкам [13]. В 2004 году Kiyoshima et al. предложили широкую диссекцию эндопельвикальной фасции от латеральных поверхностей простаты при нервсберегающей простатэктомии. Они установили, что нервно-сосудистые пучки локализованы постеролатерально относительно простаты только в 48% случаев. В остальных 52% – нервно-сосудистые пучки локализованы, в том числе, по латеральным поверхностям простаты [14]. Термины экстрафасциальная, интерфасциальная и интрафасциальная простатэктомия очень часто используются при описании различных техник диссекции простаты без четкого описания анатомических структур. В процессе экстрафасциальной простатэктомии – эндопельвикальная фасция рассекается латеральнее простаты с обнажением m. levator ani, позволяя выполнить широкую диссекцию простаты с окружающими фасциями и нервно-сосудистыми пучками.
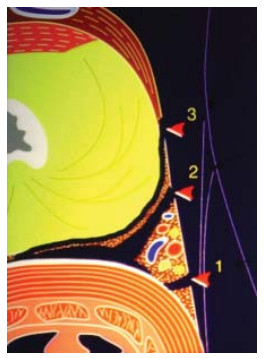
Рисунок 3. Фасциальные слои простаты (1-экстрафасциальная диссекция, 2-интерфасциальная диссекция, 3-интрафасциальная диссекция).
Figure 3. Fascial layers of the prostate (1-extrafascial dissection, 2-interfascial dissection, 3-intrasfascial dissection).
При экстрафасциальной простатэктомии (рис. 3, 4) в препарат входит предстательная железа, перипростатическая, эндопельвикальная фасции и фасция Denonvilliers (такая техника операции не является нервсберегающей).
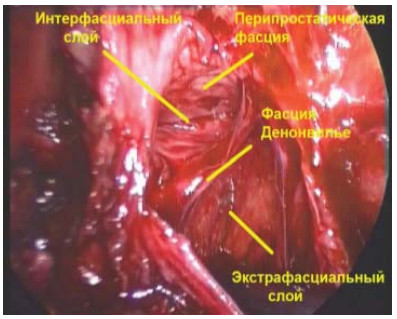
Рисунок 4. Интраоперационная дифференцировка фасциальных слоев простаты.
Figure 4. Intraoperative differentiation of fascial layers of the prostate.
При интерфасциальной простатэктомии в препарат входит предстательная железа и перипростатическая фасция (нервсберегающая методика). При интрафасциальной простатэктомии перипростатическая, эндопельвикальная фасции и фасция Denonvilliers не являются частью препарата (нервсберегающая методика – имеющая весьма ограниченные показания ввиду крайне высокого риска нарушения абластичности).
Отбор пациентов и показания к лапароскопической простатэктомии
Стандартные показания к ЛРПЭ те же что и для открытой, и для роботассистированной РПЭ: локализованный рак простаты низкого (ПСА <10 нг/мл, Gleason score <7 /от 2 до 6/, стадия cT1-2a) и РПЖ промежуточного риска (ПСА 10–20 нг/мл, или Gleason score = 7 /7(3+4) или 7(4+3)/, или стадия cT2b) и предполагаемая продолжительность жизни больше 10 лет. Цель – избавление от болезни. На сегодняшний день нет четких ограничений по возрасту для РПЭ и больных для хирургии нельзя отбирать только по возрасту. Стратификация по рискам, возраст и сопутствующие заболевания – наиболее важные факторы в выборе стратегии лечения.
При РПЖ низкого риска и ожидаемой продолжительности жизни >10 лет может быть рассмотрена тактика активного наблюдения и лучевая терапия как альтернатива РПЭ. Нервосберегающая РПЭ может быть предложена пациентам с низким риском экстракапсулярного распространения (с оценкой по таблицам/номограммам Partin [15, 16]). При локализованном РПЖ высокого риска (ПСА >20 нг/мл, Gleason score >7 /8 (4 + 4) или (3 + 5) или (5 + 3), или Gleason score 9–10/, стадия cT2c и ожидаемой продолжительности жизни >10 лет можно предложить РПЭ только в рамках мультимодального лечения. При местнораспространенном РПЖ (cT3-4, или любая T при cN+, при любом уровне ПСА и Gleason score) и ожидаемой продолжительности жизни >10 лет можно предлагать РПЭ тщательно отобранным пациентам только в рамках мультимодального лечения.
Техника радикальной лапароскопической простатэктомии
Основными современными подходами для выполнения ЛРПЭ являются:
- Трансперитонеальная антеградная простатэктомия (техника Montsouris). Именно эта техника подробно описана и широко применяется, в том числе в России [6, 17]
- Трансперитонеальная ретроградная простатэктомия (техника Heilbronn) [9]
- Экстраперитонеальная антеградная простатэктомия (Брюссельская техника) [10]
- Экстраперитонеальная ретроградная простатэктомия (модифицированная техника Heilbronn) [21]
Отличия в трансперитонеальном и экстраперитонеальном доступах отражены на схемах (рис. 5). Преимуществами лапароскопического подхода считают: хорошо определяемые анатомические ориентиры, адекватное рабочее пространство, низкая вероятность образования лимфоцеле в послеоперационном периоде. Больного укладывают на спину (рис. 6), ноги разводят в тазобедренных суставах примерно на 300 для обеспечения адекватного доступа к прямой кишке во время операции. Угол наклона стола по Тренделенбургу ~ 20-250.
Эндоскопическую стойку устанавливают в ножном конце стола. Больного фиксируют к столу за плечи, ноги, также устанавливают дополнительные упоры под плечи для предотвращения смещения больного в краниальном направлении во время операции. Оперирующий хирург и ассистент располагаются слева и справа от больного, у головного конца – ассистент, управляющий камерой (рис. 7).
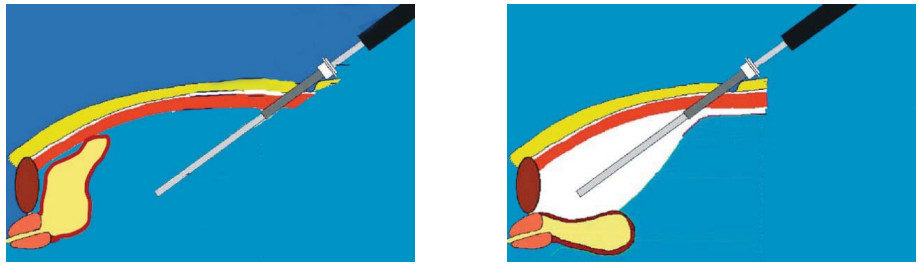
Рисунок 5. Трансперитонеальный и внебрюшинный доступы.
Figure 5. Transperitoneal and extraperitoneal approaches.
Инструменты:
- Наиболее часто на сегодняшний день при выполнении ЛРПЭ используют следующие инструменты:
- Игла Вереша – 1 шт.
- 5-мм троакар – 3 шт.
- 0-мм троакар для камеры – 1 шт.
- 12-мм троакар – 1 шт.
- Граспер (мягкий) – 1 шт.
- Монополярные ножницы – 1 шт.
- Биполярные щипцы – 1 шт.
- Иглодержатель – 1 шт.
- Ультразвуковой скальпель или LigаSure – 5 мм – 1 шт.
- Клипатор (при нервсберегающей технике)
- Диссектор – 1 шт.
- Уретральный буж с выемкой на конце – 1 шт.
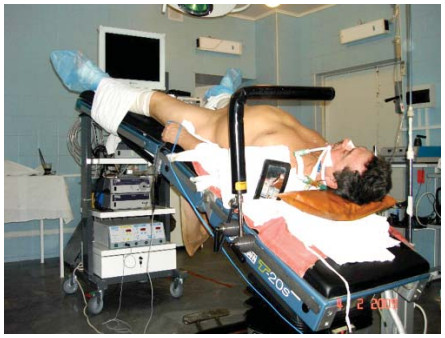
Рисунок 6. Положение пациента на операционном столе.
Figure 6. Patient’s position on the operating table.
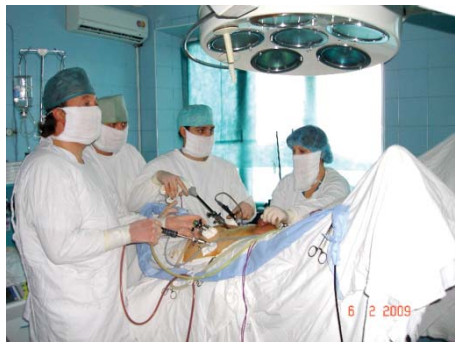
Рисунок 7. Расположение операционной бригады.
Figure 7. Location of the operating team.
Наиболее типичная схема расположения троакаров приведена на схеме (рис 8). Как вариант – возможна установка одного из 5-мм троакаров непосредственно над лоном по средней линии.
Техника лапароскопической трансперитонеальной антеградной экстрафасциальной (нерв-несберегающей) радикальной простатэктомии
При выполнении тазовой лимфаденэктомии необходимо четко визуализировать следующие анатомические структуры (рис. 9):
- Наружные подвздошные сосуды
- Медиальную умбиликальную связку
- Семявыносящий проток
- Лоно
- Запирательный нерв
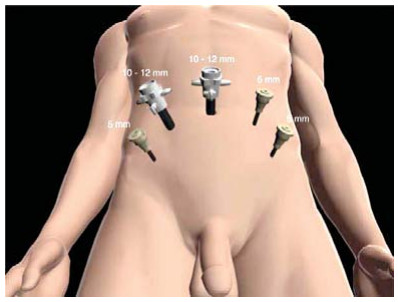
Рисунок 8. Расположение троакаров.
Figure 8. Location of trocars.
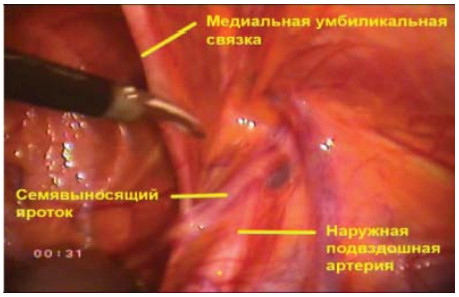
Рисунок 9. Анатомические ориентиры для выполнения лапароскопической трансперитонеальной тазовой лимфаденэктомии (правая сторона).
Figure 9. Anatomic marks for performing laparoscopic transperitoneal pelvic lymphadenectomy (right side).
Над семявыносящим протоком вдоль наружных подвздошных сосудов вскрывают париетальную брюшину. Выполняют диссекцию и пересечение семявыносящего протока, далее – диссекцию облитерированной умбиликальной артерии, вплоть до ее места выхода из внутренней подвздошной артерии. Именно такой прием гарантированно позволяет избежать травмы мочеточника, т.к. последний располагается краниальнее места выхода умбиликальной артерии из внутренней подвздошной артерии.
Диссекцию в слое продолжают до лона. Далее выполняют вскрытие фасциального футляра наружной подвздошной вены с обнажением стенки таза. После чего визуализируют и осуществляют диссекцию запирательного нерва. В первую очередь лигируют и пересекают каудальный конец, а затем краниальный конец клетчатки из запирательной ямки (рис. 10). Препарат удаляют и помещают в мешок-контейнер, последний укладывают в боковой канал (рис.11). В мочевой пузырь по катетеру Foley вводят 150 мл стерильного раствора, что позволяет четко визуализировать контуры мочевого пузыря.
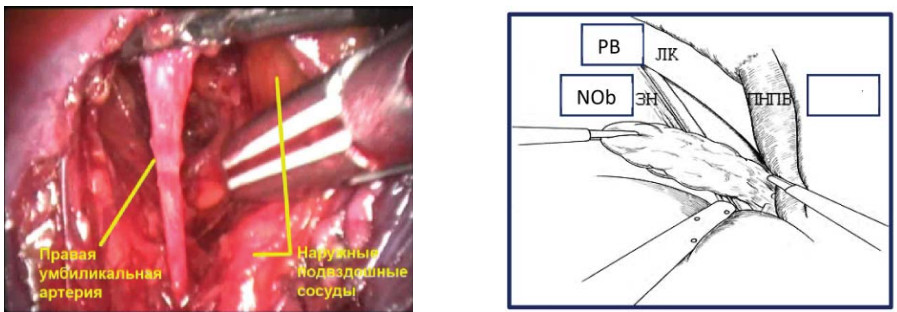
Рисунок 10. Лапароскопическая трансперитонеальная тазовая лимфаденэктомия (ЛК – лонная кость, ЗН – запирательный нерв, ПНПВ – правая наружная подвздошная вена).
Figure 10. Laparoscopic transperitoneal pelvic lymphadenectomy (PB - pubic bone, NOb - n. obturatorius, REIV - right external iliac vein).
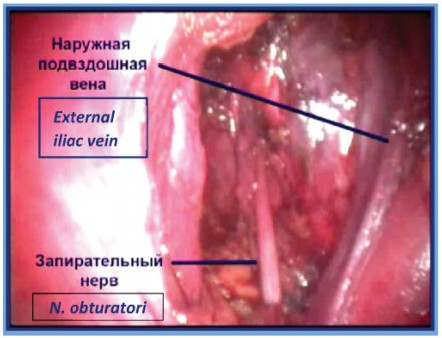
Рисунок 11. Окончательный вид после лапароскопической трансперитонеальной тазовой лимфаденэктомии.
Figure 11. Final form after laparoscopic transperitoneal pelvic lymphadenectomy.
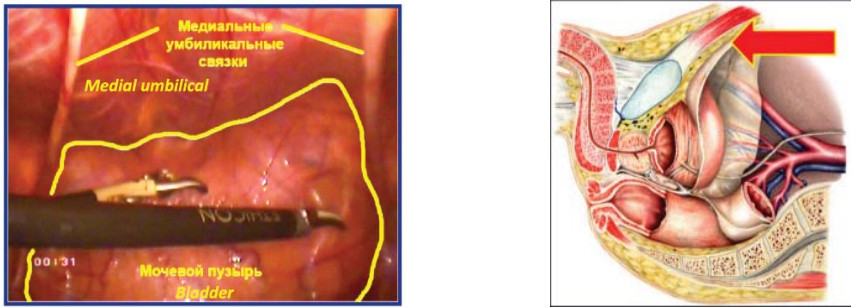
Рисунок 12. Мобилизация мочевого пузыря, поход к предстательной железе.
Figure 12. Mobilization of the bladder, a trip to the prostate gland.
Первый этап – подход к предстательной железе, вскрытие эндопельвикальной фасции Париетальную брюшину рассекают латеральнее и вдоль медиальных умбиликальных связок с обеих сторон (рис. 12). Производят диссекцию тканей Ретциевого пространства с пересечением urachus и медиальных умбиликальных связок на уровне linea arcuatae. Мочевой пузырь опорожняют. Далее по срединной линии устанавливают дополнительный 5-мм троакар на середине расстояние между пупком и лоном.
Жировую клетчатку над предстательной железой и эндопельвикальной фасцией в латеральных направлениях коагулируют биполярным инструментом и удаляют, для чёткого обнажения внутритазовой фасции и лонно-простатических связок. Эндопельвикальную фасцию рассекают по линии изгиба с обеих сторон и далее в проекции нервно-сосудистых пучков до мочевого пузыря, обеспечивая доступ к мышцам тазового дна. Последние с помощью тупой диссекции отсепаровывают от боковых поверхностей предстательной железы. На этом этапе коагулируется поверхностная дорзальная вена (рис. 13).
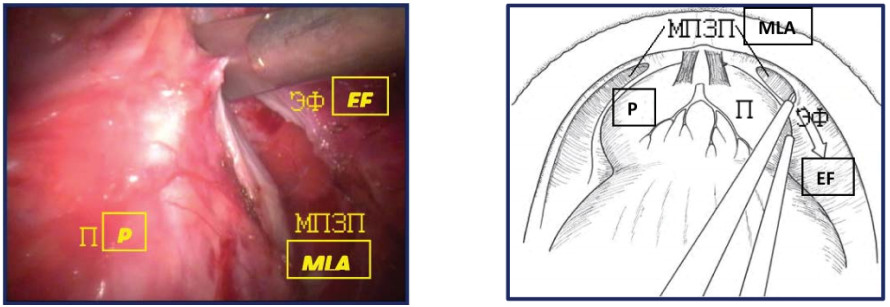
Рисунок 13. Вскрытие эндопельвикальной фасции (П – предстательная железа, ЭФ – эндопельвикальная фасция, МПЗП – мышцы поднимающие задний проход).
Figure 13. Opening of the endopelvic fascia (P - prostate, EF - endopelvic fascia, MLA – m. levator ani).
Второй этап – пересечение шейки мочевого пузыря, доступ к семенному комплексу Операционная сестра выполняет тракцию уретрального катетера Foley с баллоном инсуффлированным на 20 мл, при этом четко визуализируется граница между шейкой мочевого пузыря и предстательной железой. С помощью УЗ-скальпеля (или LigаSure-5 мм) производят диссекцию передней полуокружности шейки мочевого пузыря (рис. 14).
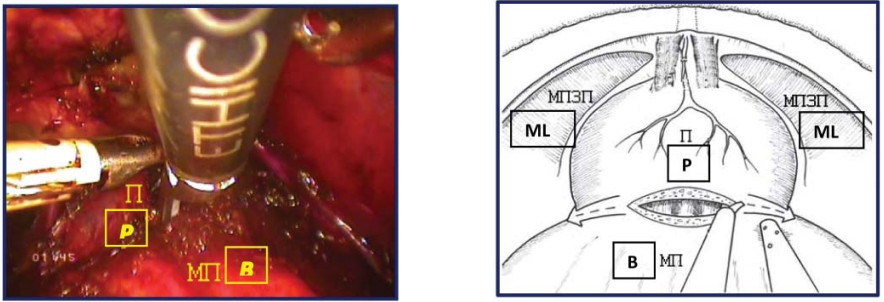
Рисунок 14. Пересечение передней полуокружности шейки мочевого пузыря (П – предстательная железа, МП – мочевой пузырь, МПЗП – мышцы поднимающие задний проход).
Figure 14. Intersection of the anterior semicircle of the neck of the bladder (P - prostate, B - bladder, MLA – m. levator ani).
После пересечения передней полуокружности шейки мочевого пузыря уретральный катетер меняют на металлический буж. С помощью бужа предстательная железа поднимается максимально вверх, что обусловливает оптимальную визуализацию задней полуокружности шейки мочевого пузыря и позволяет визуализировать устья мочеточников. На этом этапе пересекают заднюю полуокружность шейки мочевого пузыря. Осуществляя тракцию за последнюю кверху, хирург входит с помощью «тупой» диссекции в пространство между задней стенкой мочевого пузыря и простатой в промежутке от 5 до 7 часов условного циферблата.
Если «тупая» диссекция не удается легко, это означает неверное определение слоя. В этом случае увеличивают тракцию задней полуокружности шейки мочевого пузыря краниально и предстательной железы кверху и продолжают диссекцию строго по средней линии, до визуализации семявыносящих протоков (рис. 15).
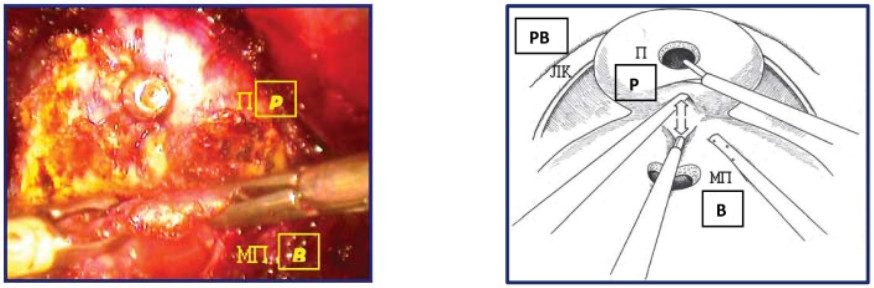
Рисунок 15. Пересечена задняя полуокружность шейки мочевого пузыря (П – предстательная железа, МП – мочевой пузырь, ЛК – лонная кость).
Figure 15. The posterior semicircle of the neck of the bladder is intersected (P - prostate, B - bladder, PB - pubic bone).
Третий этап – выделение семявыносящих протоков и семенных пузырьков Конечным этапом диссекции задней полуокружности шейки мочевого пузыря является идентификация ампуллярных порций семенных пузырьков. Когда структуры идентифицированы, производят расширение диссекции стенки мочевого пузыря в латеральных направлениях. Семявыносящий проток выделяют от уровня предстательной железы в направлении мочевого пузыря, что облегчает латеральный доступ к семенным пузырькам (рис. 16).
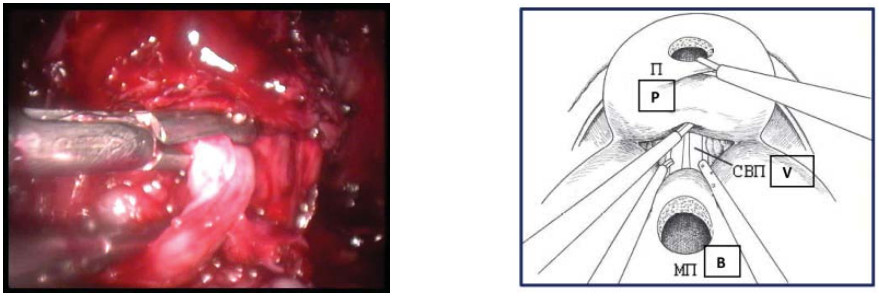
Рисунок 16. Выполнена диссекция левого семявыносящего протока (П – предстательная железа, СВП – семявыносящий проток, МП – мочевой пузырь).
Figure 16. Dissection of the left vas deferens (P - prostate, VD - vas deferens, B - bladder).
При этом важно, чтобы ассистент осуществлял достаточное отведение мочевого пузыря книзу для обеспечения лучшегодоступа к семявыносящему протоку. После пересечения семявыносящего протока семенной пузырёк визуализируется несколько латеральнее. Ассистент захватывает его граспером и осуществляет ретракцию в латерокраниальном направлении, а отсосом продолжает отведение мочевого пузыря книзу. После этого выполняют пошаговую диссекцию семенного пузырька от окружающих тканей. Аналогичным образом выполняют диссекцию семенного комплекса с контрлатеральной стороны (рис. 17).
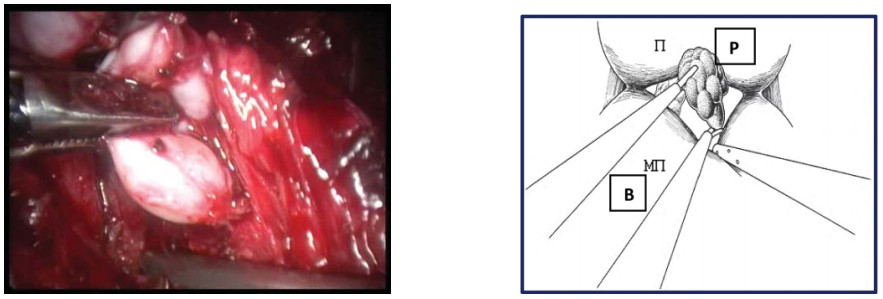
Рисунок 17. Выполняется диссекция правого семенного пузырька (П – предстательная железа, МП – мочевой пузырь).
Figure 17. Dissection of the right seminal vesicle (P - prostate, B - bladder).
Четвертый этап – вскрытиефасции Denonvilliers После мобилизации семенного комплекса последний захватывается ассистентом и отводится вертикально вверх. Производят вскрытие фасции Denonvilliers с обнажением преректального жира. Выполняют диссекцию в слой задней поверхности простаты от передней поверхности прямой кишки с визуализацией ножек простаты (рис. 19).
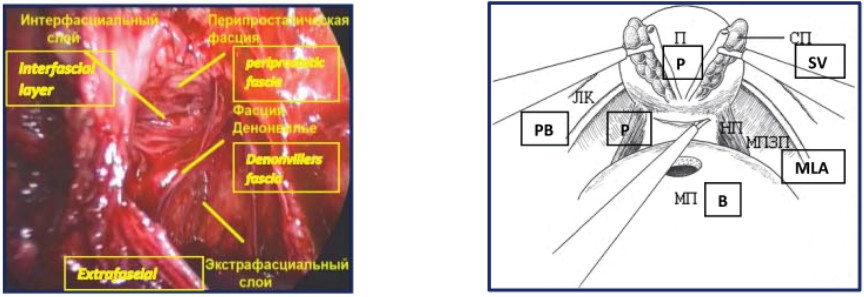
Рисунок 18. Фасция Denonvilliers вскрыта (П – предстательная железа, МП – мочевой пузырь, ЛК – лонная кость, НП – ножка простаты, МПЗП – мышцы поднимающие задний проход, CП – семенной пузырёк).
Figure 18. The Denonvilliers` fascia was opened (P – prostate, B – bladder, PB - pubic bone, PP – prostate pedunculus, MLA – m. levator ani, SV – seminal vesicle).
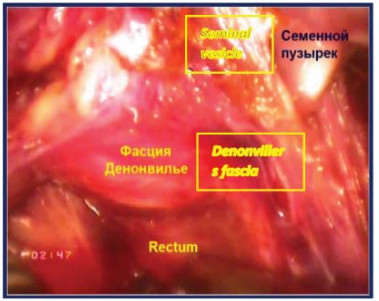
Рисунок 19. Выполнена экстрафасциальная диссекция задней поверхности простаты от прямой кишки.
Figure 19. Extrafascial dissection of the prostate` posterior surface from the rectum was performed.
Пятый этап – пересечение ножек предстательной железы Лигирование и пересечение ножек простаты с обеих сторон при экстрафасциальной простатэктомии (т.е. без сохранения нервно-сосудистых пучков) выполняют с помощью биполярной электрокоагуляции (рис. 20).
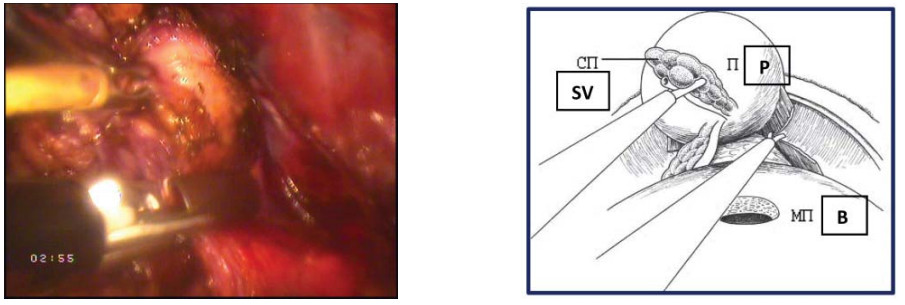
Рисунок 20. Пересечение правой ножки простаты (П – предстательная железа, СП – семенной пузырек, МП – мочевой пузырь).
Figure 20. Intersection of the right prostate pedunculum (P – prostate, SV – seminal vesicle, B – bladder).
Шестой этап – апикальная диссекция простаты
- Пересечение дорзального венозного комплекса Следующим этапом выполняют лигирование дорзального венозного комплекса. Операционная сестра с помощью уретрального бужа подает простату максимально вниз, тем самым растягивая пубо-простатические связки и дорзальный венозный комплекс (рис.21).
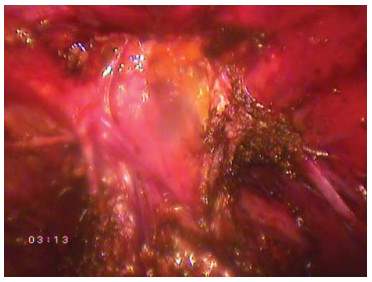
Рисунок 21. Пубо-простатические связки растянуты за счет ретракции простаты уретральным бужом.
Figure 21. Pubo-prostatic ligaments are stretched due to retraction of the prostate by urethral bougie.
Зажим Babcock накладывают на дорзальный венозный комплекс. Непосредственно под зажимом выполняют 8-образный викриловый шов 2/0 на колющей 36 мм игле. При этом второй «вкол» иглы проходит более поверхностно, что улучшает гемостаз. Далее выполняют пересечение пубо-простатических связок с дорзальным венозным комплексом. Альтернативой является пересечение дорзального венозного комплекса с помощью биполярной коагуляции (аппаратом LigaSure®) (рис. 22).
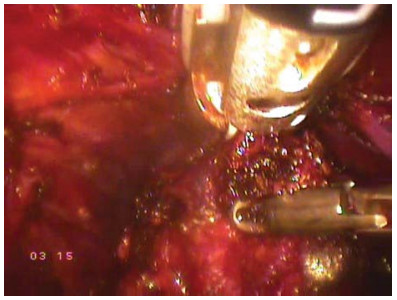
Рисунок 22. На дорзальный венозный комплекс наложен аппарат LigaSure® (прямой вид).
Figure 22. LigaSure® apparatus is imposed on the dorsal venous complex (direct view).
- Пересечение уретры. На фоне противотракции уретральным бужом, выполняют диссекцию парауретральных тканей, пересечение передней полуокружности уретры. На этом этапе уретральный буж перемещают в зону вскрытой уретры и выполняют тракцию вверх. Пересекается задняя полуокружность уретры (рис. 23, 24).
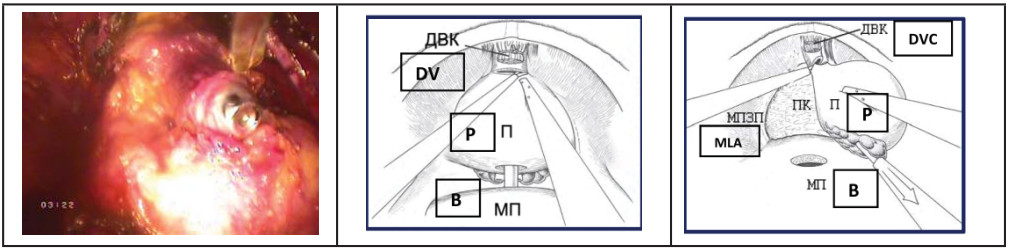
Рисунок 23. Передняя полуокружность уретры пересечена (ДВК – дорзальный венозный комплекс, П – предстательная железа, МП – мочевой пузырь, МПЗП – мышца поднимающие задний проход).
Figure 23. The anterior semicircle of the urethra was crossed (DVC - dorsal venous complex, P - prostate, B – bladder, MLA – m. levator ani)
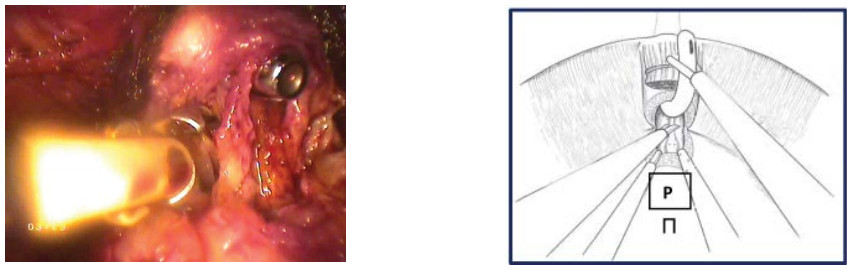
Рисунок 24. Выделение задней полуокружности уретры (П - предстательная железа).
Figure 24. Urethra`s posterior semicircle isolation (P - prostate).
- Пересечение прямокишечно-уретральной мышцы. Предстательная железа поднимается вверх и удерживается ассистентом, прямокишечно-уретральная мышца натягивается, она является последним элементом, удерживающим простату. С латеральных сторон осторожно пересекают прямокишечно-уретральную мышцу ближе к предстательной железе и предстательная железа окончательно высвобождается. Предстательную железу помещают в мешокконтейнер, последний укладывают в боковой канал брюшной полости (рис. 25).
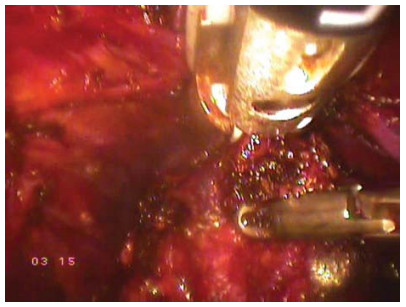
Рисунок 25. Пересекается ректо-уретральная мышца.
Figure 25. Recto-urethral muscle is crossed
Седьмой этап – пузырно-уретральный анастомоз
Наиболее широко применяют три основные методики наложения пузырно-уретрального анастомоза:
- Узловой анастомоз (методика «Montsouris» [8]). Первый шов накладывают на 5 часах у. ц., затем на 6`, 7` (задняя полуокружность – уретру прошивают изнутри наружу, шейку мочевого пузыря – снаружи внутрь), 9`, 3`, 1` и 11 ` у. ц. (передняя полуокружность – уретру прошивают снаружи внутрь, шейку мочевого пузыря – изнутри наружу) (рис. 26).
- Непрерывный анастомоз (методика Creteil [22]). Начиная с 3 часов у. ц. до 9 часов у. ц. ушивают непрерывным швом заднюю полуокружность. Далее, начиная с 2 часов у. ц. до 10 часов у. ц., накладывают непрерывный шов на переднюю полуокружность анастомоза (рис. 27).
- Непрерывный одноузловой анастомоз [23]. Нить для наложения анастомоза готовят из двух отдельных атравматичных нитей длиной 12-18 см каждая, которые связывают между собой на концах противоположных иглам. Непрерывный шов начинают с прошивания шейки мочевого пузыря снаружи внутрь, обеими иглами на 5.30 и 6.30 часах у. ц. Затем прошивают уретру изнутри наружу. Далее обе полуокружности уретры прошивают непрерывными обвивными стежками до 12 часов у. ц., где нити связываются между собой (рис. 28).

Рисунок 26. Техника наложения пузырно-уретрального анастомоза по методике «Montsouris».
Figure 26. Technique of imposing a vesicoureteral anastomosis using «Montsouris» method)
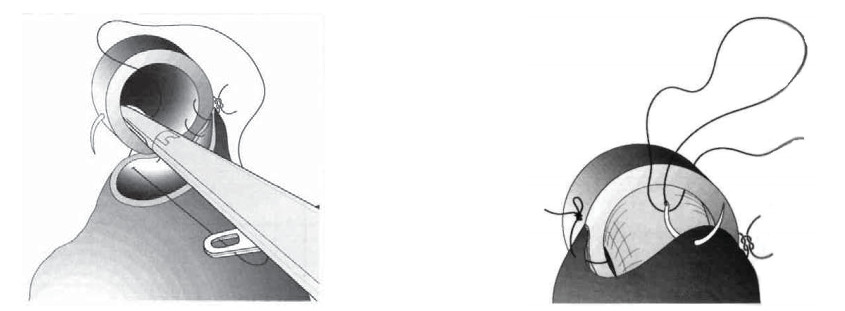
Рисунок 27. Техника наложения непрерывного пузырно-уретрального анастомоза по методике «Creteil».
Figure 27. Technique of imposing of a continuous vesicoureteral anastomosis using «Creteil» method.

Рисунок 28. Техника наложения непрерывного одноузлового пузырно-уретрального анастомоза.
Figure 28. Technique of imposing of a continuous single-node vesicoureteral anastomosis.
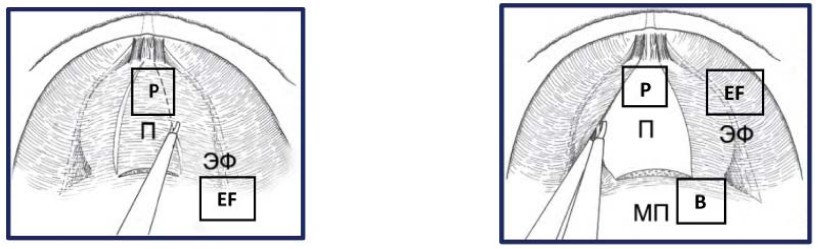
Рисунок 29. Рассечение эндопельвикальной фасции (П – предстательная железа, ЭФ – эндопельвикальная фасция, МП – мочевой пузырь).
Figure 29. Dissection of the endopelvic fascia (P – prostate, EF – endopelvic fascia, B – bladder).
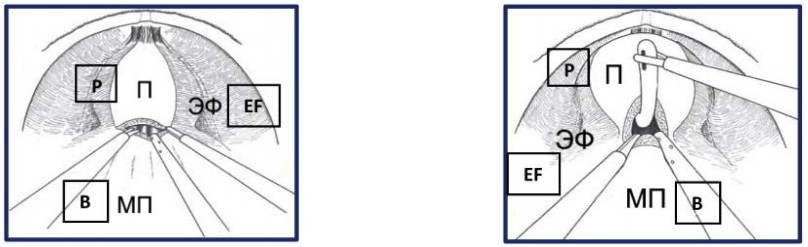
Рисунок 30. Пересечение шейки мочевого пузыря (П – предстательная железа, ЭФ – эндопельвикальная фасция, МП – мочевой пузырь).
Figure 30. Intersection of the bladder`s neck (P – prostate, EF - endopelvic fascia, B - bladder).
После завершения формирования пузырно-уретрального анастомоза проверяют его герметичность путем наполнения мочевого пузыря по уретральному катетеру стерильным раствором объемом 150 мл. Брюшную полость дренируют трубчатым дренажем в подвздошной области через троакарное отверстие. Через расширенное надлонное троакарное отверстие удаляют контейнер с препаратами.
Техника лапароскопической трансперитонеальной антеградной интерфасциальной (нервсберегающей) радикальной простатэктомии [24]
На первом этапе операции эндопельвикальную фасцию рассекают с обеих сторон по передней поверхности предстательной железы, начиная от шейки мочевого пузыря к верхушке простаты, медиальнее пубо-простатических связок, с доступом в интерфасциальный слой. В этом слое эндопельвикальная фасция отделяется по переднебоковым поверхностям простаты от перипростатической фасции. Это позволяет высвободить предстательную железу в пределах перипростатической фасции с сохранением эндопельвикальной фасции и пубо-простатических связок (рис. 29). Второй этап выполняется принципиально так же, как и при экстрафасциальной методике. Отличием является меньшее выделение детрузора в латеральных направлениях от места пересечения шейки мочевого пузыря (рис. 30).
Основным отличием доступа к семенному комплексу является необходимость работы в более узком пространстве, ограниченном сохраненными боковыми прикреплениями – листками эндопельвикальной фасции и нервно-сосудистыми пучками (рис. 31).
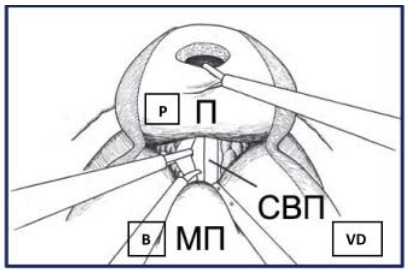
Рисунок 31. Доступ к семенному комплексу (П – предстательная железа, СВП – семявыносящий проток, МП – мочевой пузырь).
Figure 31. Access to the seminal complex (P – prostate, VD – vas deferens, B – bladder).
На третьем этапе ЛРПЭ при диссекции семенных пузырьков клипируют артерии, подходящие к семенным пузырькам (воздержаться от электрокоагуляции), т.к. в этой зоне к верхушкам семенных пузырьков вплотную прилежат нейроваскулярные волокна. Четвертый этап. После выделения семенного комплекса становится видна фасция Denonvilliers. В отличие от экстрафасциальной техники фасция не вскрывается. Слой диссекции продолжается по задней поверхности простаты между фасцией Denonvilliers и перипростатической фасцией (рис. 32).
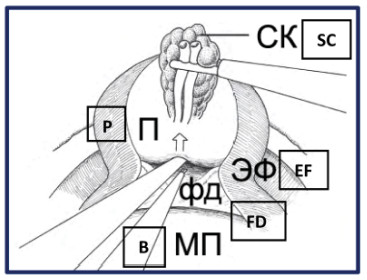
Рисунок 32. Интерфасциальная диссекция задней поверхности простаты (П – предстательная железа, СК – семенной комплекс, МП – мочевой пузырь, фд – фасция Denonvilliers , ЭФ – эндопельвикальная фасция).
Figure 32. Interfascial dissection of the prostate`s posterior surface (P – prostate, SC – seminal complex, B – bladder, FD – fascia Denonvilliers, EF – endopelvic fascia).

Рисунок 33. Пересечение ножек простаты (П – предстательная железа, СК – семенной комплекс, МП – мочевой пузырь, ЭФ – эндопельвикальная фасция).
Figure 33. Intersection of the prostate`s pedunculi (P – prostate, SC – seminal complex, B – bladder, EF – endopelvic fascia).
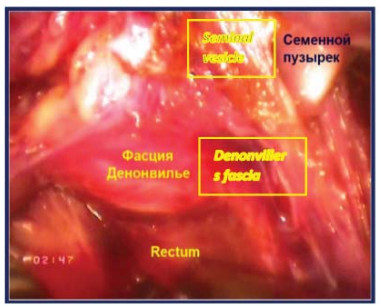
Рисунок 34. Лигирование дорзального венозного комплекса (П – предстательная железа, ППС – пубо-простатические связки).
Figure 34. Ligation of the dorsal venous complex (P – prostate, PPL – pubo-prostatic ligaments).
Визуальное отличие интерфасциального слоя от экстрафасциального заключается в отсутствии преректального жира. Ввиду чего диссекция в интерфасциальном слое происходит менее податливо. Разделение фасций начинают строго по средней линии для предотвращения повреждения сосудисто-нервных пучков. Далее поэтапно - в направлении ножек простаты и нервно-сосудистых пучков. Пятый этап. Фасция Denonvilliers остаётся на прямой кишке. Эндопельвикальную фасцию с сосудисто-нервными пучками отслаивают от перипростатической капсулы вплоть до латеральной поверхности простаты, ножки клипируют и пересекают (рис. 33).
Шестой этап. Следует воздерживаться от использования электрокоагуляции при апикальной диссекции простаты, т.к. нервно-сосудистые пучки сходятся в области верхушки простаты. Лигирование дорзального венозного комплекса выполняют с сохранением пубо-простатических связок (рис. 34). Кроме того, выделение простаты по перипростатической фасции исключает необходимость пересечения ректо-уретральной мышцы. Таким образом нервсберегающую технику ЛРПЭ (интерфасциальная) выполняют без вскрытия фасции Denonvilliers и без пересечения ректо-уретральной мышцы. При наложении пузырно-уретрального анастомоза избегают «захватывания» в шов эндопельвикальной фасции и нейроваскулярных волокон. Это наиболее важно на 4-5 и 7-8 часах условного циферблата.
Осложнения лапароскопической простатэктомии
Адекватное инструментальное обеспечение является критически важным для лапароскопической хирургии. Следует отметить, что использование современных самофиксирующихся в передней брюшной стенке троакаров, либо принудительная их фиксация, а также применение современных электрохирургических лапароскопических инструментов (биполярных диссекторов, зажимов, ультразвукового скальпеля, LigaSure® и т. п.) минимизирует затраты времени на интраоперационные инструментальные манипуляции и снижает риск осложнений.
Объем кровопотери колеблется от 50,0 до 770,0 мл и в среднем составляет 185,0 мл. Длительность лимфореи, требующей сохранения страховых выпускников в среднем - 6-7 суток (от 3 до 23 сут.). Подтекание мочи в анастомозе, определяемое при выполнении восходящей цистографии, выявляется в раннем послеоперационном периоде в 5,3%, что требует более пролонгированного стояния уретрального катетера.
Литература:
- Бакетин П.С., Моллаев Р.А., Мазуренко Д.А., Григорьев Schuessler WW, Kavoussi LR, Clayman RV, Vancaille T. Laparoscopic radical prostatectomy: iniƟ al case report. J Urol. 1992; 147: 246A [Abstract № 130]
- Schuessler WW, Schulam PG, Clayman RV, Kavoussi LR. Laparoscopic radical prostatectomy: initial short-term experience. Urology. 1997;50(6):854-857. DOI: 10.1016/ S0090-4295(97)00543-8
- Rabboy A, Ferzli G, Albert P. Initial experience with extraperitoneal endoscopic radical retropubic prostatectomy. Urology. 1997;50(6):849-853. DOI: 10.1016/S0090-4295(97)00485-8
- Kavoussi LR, Schuessler WW, Vancaille TG, Clayman RV. Laparoscopic approach to the seminal vesicle. J Urol. 1993;150(2 Pt 1):417-419. PMID: 8326567
- Gill IS. Textbook of laparoscopic urology. Informa Healthcare USA. 2006; 1166 pp.
- Guillonneau B, Cathelineau X, Barret E, Rozet F, Vallancien G. Laparoscopic radical prostatectomy: technical and early oncological assessment of 40 operations. Eur Urol. 1999;36(1):14-20 DOI: 10.1159/000019921
- Abbou CC, Salomon L, Hoznek A. Antiphon P, Cicco A, Saint F, Alame W, Bellot J, Chopin DK. Laparoscopic radical prostatectomy: preliminary results. Urology. 2000;55(5):630-634. PMID: 10792066
- Guillonneau B, Vallancien G. Laparoscopic radical prostatectomy: the Montsouris experience. J Urol. 2000;163(2):418-422. PMID:10647644
- Rassweiler J, Sentker L, Seemann O, Hatzinger M, Stock C, Frede T. Heilbronn laparoscopic radical prostatectomy. Technique and results after 100 cases. Eur Urol. 2001;40(1):54-64. DOI: 10.1159/000049749
- Bolens R, Vanden Bossche M, Rhoumeguere TH, Damoun A, Ekane S, Hoffmann P, Zlotta AR, Schulman CC. Extraperitoneal laparoscopic radical prostatectomy: result after 50 cases. Eur Urol. 2001;40:65-69. DOI:10.1159/000049750
- Patel VR, Coelho RF, Palmer KJ, Rocco B. Periurethral suspension stitch during robot-assisted laparoscopic radical prostatectomy: description of the technique and continence outcomes. Eur Urol. 2009;56(3):472-478. DOI: 10,1016 / j.eururo.2009.06.007
- Rocco F, Carmignani L, Acquati P. Gadda F, Dell’Orto P, Rocco B, Bozzini G, Gazzano G, Morabito A. Restoration of posterior aspect of rhabdosphincter shortens continence time after radical retropubic prostatectomy. J Urol. 2006;175(6):2201– 2206. DOI: 10.1016/S0022- 5347(06)00262-X
- Menon M, Tewari A, Peabody J. Vattikuti Institute prostatectomy: Technique. J Urol. 2003;169(6):2289–2292 DOI: 10.1097/01.ju.0000067464.53313.dd.
- Kiyoshima K, Yokomizo A, Yoshida T, Tomita K, Yonemasu H, Nakamura M, Oda Y, Naito S, Hasegawa Y. Anatomical features of periprostatic tissue and its surroundings: a histological analysis of 79 radical retropubic prostatectomy specimens. Jpn J Clin Oncol. 2004;34(8):463–468. DOI: 10.1093/jjco/hyh078
- Partin AW, Mangold LA, Lamm DM, Walsh PC, Epstein JI, Pearson JD. Contemporary update of prostate cancer staging nomograms (Partin Tables) for the new millennium. Urology. 2001;58(6):843-8. PMID: 11744442
- Eifler JB, Feng Z, Lin BM, Partin MT, Humphreys EB, Han M, Epstein JI, Walsh PC, Trock BJ, Partin AW. An updated prostate cancer staging nomogram (Partin tables) based on cases from 2006 to 2011. BJU Int. 2013;111(1):22-9. DOI: 10.1111/j.1464-410X.2012.11324.x.
- Пушкарь Д.Ю., Раснер П.И. Диагностика и лечение локализованного рака предстательной железы. М.: МЕДпресс-информ:2008: 320.
- Матвеев В.Б., Алексеев Б.Я. Лапароскопическая хирургия в онкоурологии. М.: АБВ-пресс; 2007:216.
- Коган М.И., Лоран О.Б., Петров С.Б. Радикальная хирургия рака предстательной железы. М.: ГЭОТАР-Медиа; 2006:352.
- Медведев В.Л., Костюков С.И., Стрионов С.И., Вакуленко И.Т. Новая технология в хирургии рака предстательной железы. Современные возможности и направления в диагностике и лечении рака почек, мочевого пузыря и предстательной железы: сборник. Уфа; 2001:72-74.
- Rassweiler J, Sentker L, Seemann O, Hatzinger M, Rumpelt HJ. Laparoscopic radical prostatectomy with the Heilbronn technique: an analysis of the first 180 cases. J Urol. 2001;166(6):2101-2108. PMID: 11696715
- Hoznek A, Salomon L, Rabii R, Ben Slama MR, Cicco A, Antiphon P, Abbou CC. Vesicourethral anastomosis during laparoscopic radical prostatectomy: the running suture method. J Endourol. 2000;14(9):749-53. DOI: 10.1089/ end.2000.14.749
- Van Velthoven RF, Ahlering TE, Peltier A, Skarecky DW, Clayman RV. Technique for laparoscopic running urethrovesical anastomosis:the single knot method. Urology. 2003;61(4):699-702.
- Stolzenburg JU, GeƩ man MT, Liatsikos EN, eds. Endoscopic Extraperitoneal Radical Prostatectomy Laparoscopic and Robot-Assisted Surgery. New York: Springer-Verlag Berlin Heidelberg; 2007:195.