Перепанова Т.С., Меринов Д.С., Казаченко А.В., Толордава Э.Л., Малова Ю.А.
Развитие инфекционно-воспалительных осложнений (ИВО) после урологических операций чаще всего связано с госпитальной инфекцией, однако после перкутанной нефролитотрипсии (ПНЛТ) развитие ИВО имеет свои особенности. Наличие биопленок снаружи и внутри камня, особенно коралловидного, способствует высвобождению эндотоксина и других факторов патогенности возбудителей во время дробления камня. Развитие синдрома системной воспалительной реакции (ССВР) после ПНЛТ часто расценивается как «атака пиелонефрита» и пациентов лечат соответственно этому диагнозу.
Конечно, у части пациентов состояние может осложниться развитием тяжелых инфекционных осложнений – бактериемии, уросепсиса, пиелонефрита и т.д. M.S. Michel с соавт. отмечали развитие лихорадки у 21,0-32,1% больных, тогда как такие тяжелые осложнения, как септицемия встречались в 0,3-4,7% [1]. Лихорадка, развившаяся в послеоперационном периоде после ПНЛТ была отмечена у 10,5% больных в исследовании CROES study. Однако, как отмечают авторы, не всегда она ассоциировалась с развитием инфекционного процесса [2].
В исследовании M. Rivera пациенты получали обширную антибактериальную терапию при наличии положительного культурального анализа мочи или камня, всем остальным проводили антимикробную терапию в течение 7 дней до и 7 дней после ПНЛТ. Авторы пытались идентифицировать пре- и послеоперационные предикторы инфекционных осложнений. Из 227 пациентов, подвергшихся ПНЛТ инфекционные осложнения отмечены у 37 (16%), из них: у 11 (5%) ИМП/пиелонефрит; у 21 (9%) – ССВР и у 2-х пациентов (0.9%) развился сепсис.
Не отмечено значительных различий в группах пациентов с инфекционными осложнениями и без них в отношении возраста, пола, размера камня, наличия сахарного диабета или длительности операции. По результатам проведенного однофакторного анализа выявлено, что наличие струвитного состава камня, положительной культуры камня во время операции, коралловидного камня и множественных камней, ассоциировалось с риском послеоперационных инфекционных осложнений.
Однако при проведении мультивариантного анализа выявлено, что только коралловидные камни ассоциировались с развитием лихорадки/ССВР/сепсиса (OR 3.14; p=0,02) и общими инфекционными осложнениями (OR 2,53; p=0,02) [(3]. К независимым факторам риска развития ИВО после ПНЛТ также относят наличие сахарного диабета (OR=4,511, p=0,001), длительность операции (OR=2,588, p=0,043, длительную ирригацию (OR=2,353, p=0,036) и инфекционный генез камней (OR=5,862, p=0,001)[4].
Также наличие положительной культуры камня и антеградный стент, как факторы риска развития послеоперационных ИВО, подтверждают и S. Bolomytis и соавт. [5], тогда как наличие резидуальных камней и множественных доступов во время ПНЛТ не являлись факторами риска. В руководстве Европейской урологической Ассоциации (ЕУА) 2018 г. опубликовано всего 10 строчек об эффективности разных режимов антибактериальной профилактики перед нефролитотрипсией [6].
Сравнив частоту развития ССВР после ПНЛТ при применении комбинации сульбактама/ампициллина или цефуроксима не выявлено различий в показателях ССВР или уросепсиса [7]. E. Tuzel и соавт. сравнивали однократное введение цефтриаксона и комбинацию цефтриаксона и цефалоспорина 3-го поколения до удаления нефростомы (в среднем, через 1-3 дня) у 73 пациентов. Они не обнаружили различий в частоте инфекционных осложнений между двумя режимами [8].
Таким образом, Руководство ЕУА рекомендует однократно вводить профилактическую дозу антибиотика для снижения риска симптоматических ИМП после перкутанной нефролитотрипсии, причем степень рекомендации – сильная [6]. Развитию инфекционных осложнений также способствует установка уретральных катетеров, стентов, нефростом после ПНЛТ с развитием т.н. «катетер-ассоциированной инфекции мочевых путей». С первых часов установки катетеров и дренажей начинается контаминация их микроорганизмами с формированием различных биопленок на их поверхностях.
В условиях антибиотикорезистентности, а также с учетом специфики возникновения развития мочевой инфекции после перкутанной нефролитотрипсии, актуален поиск альтернативных методов, направленных на улучшение результатов лечения пациентов с камнями почек инфекционного генеза, уменьшение числа рецидивов камней после перкутанной нефролитотрипсии.
Одной из таких альтернатив может стать применение препаратов бактериофагов до и после перкутанной нефролитотрипсии. Наши исследования, проведенные совместно с НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи показали возможность проникновения бактериофагов в биопленки.
МАТЕРИАЛЫ И МЕТОДЫ
Наблюдательное исследование проведено на базе 1-го урологического отделения НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиала НМИЦ радиологии Минздрава России в 2018 г.
Цель исследования: изучение эффективности применения Пиобактериофага поливалентного очищенного для лечения и профилактики развития инфекционных осложнений после перкутанной нефролитотрипсии.
Исследование проведено у 60 пациентов с большими и коралловидными камнями почек, которым выполняли ПНЛТ. Больным проводили антимикробную периоперационную профилактику: за 2 часа до операции назначали либо антибиотик, либо препарат пиобактериофаг. Также помещали на 30 минут до операции уретральные катетеры и дренажи в препарат пиобактериофага. Временные отрезки выбраны на основании результатов предварительно проведенных научных исследований в НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи (2016-2018гг). Эти исследования показали, что предварительная обработка катетеров фаговыми препаратами несколько уменьшает количество микроорганизмов, прикрепленных к поверхности катетеров (рис. 1).
При этом, увеличение времени экспозиции катетера в фаговом растворе никакого существенного значения не имело. В то же время при исследовании влияния препаратов бактериофагов на уже сформированные биопленки клиническими изолятами микроорганизмов было показано, что препарат бактериофага способен разрушать «свежие» (сформированные в течение 2-6 часов) бактериальные биопленки (рис. 2). Исследования «in vitro» показали, что оптимальным временем инкубации «зрелой» (суточной) биопленки в фаговом препарате является 18 часов. При таком времени инкубации зрелая биопленка практически полностью гибнет.
Таким образом, проведенные исследования препарата «Пиобактериофаг поливалентный очищенный» в НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи показали следующее:
- обработка катетеров фаговым препаратом замедляет процесс обсеменения катетеров микроорганизмами;
- оптимальное время экспозиции фагового препарата на поверхности катетеров/нефростом 30 мин;
- «Пиобактериофаг поливалентный очищенный» разрушает свежую бактериальную биопленку. Более длительная инкубация фагового препарата (в течение 18 часов) способна разрушать даже зрелые (суточные) бактериальные пленки.
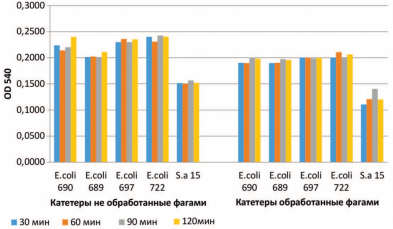
Рис. 1. Сравнительный анализ микробного обсеменения нативных катетеров и катетеров, обработанных фаговыми препаратами в динамике. OD 540 – оптическая плотность при длине волны 540 нм
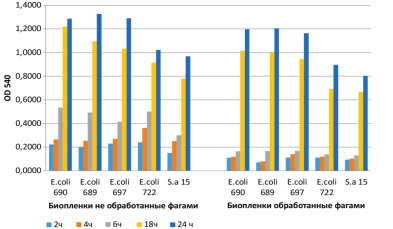
Рис. 2. Влияние фагового препарата «Пиобактериофаг поливалентный очищенный» на сформированные биопленки клинических изолятов. OD 540 – оптическая плотность при длине волны 540 нм
Исследуемый препарат: Пиобактериофаг поливалентный очищенный, производства АО «НПО «Микроген». Препарат содержит смесь очищенных фильтратов фаголизатов бактерий Staphylococcus spp, Streptococcus spp, Proteus spp, Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli.
Клиническая часть исследования Для профилактики инфекционно-воспалительных осложнений препарат Пиобактериофаг поливалентый очищенный назначали перорально в дозе 40 мл однократно внутрь за 2 часа до операции и в послеоперационном периоде по 40 мл 3 раза в день в течение 3-5 дней или проводили периоперационную антибактериальную профилактику (ципрофлоксацин 1г внутривенно капельно в течение всей операции) и антибактериальную терапию в послеоперационном периоде от 3 до 5 дней, в зависимости от результатов чувствительности выделенных микроорганизмов или продолжали ципрофлоксацин.
Катетеры и нефростомические дренажи перед их установкой погружали в раствор пиобактериофага поливалентного очищенного, время экспозиции 30 минут.
Пациенты, в зависимости от результатов бактериологического анализа мочи до операции были разделенына 4 группы (табл. 1).
Катетеры и дренажи исследовали на микрофлору (посев) во всех 4-х группах пациентов в следующие сроки:
- на 1 сутки после операции – уретральный катетер;
- на 3-4 сутки – нефростомический дренаж.
Была разработана карта наблюдения пациента, как в бумажномварианте, так и в электронном виде. Данные на пациентов заносили в таблицу EXСEL, в которых регистрировали ФИО, номер группыпо нашему исследованию, анамнестические данные, диагноз, размер и форма камня, наличие сопутствующих заболеваний (сахарный диабет, хроническая почечная недостаточность, гидронефроз).
Отмечали длительность заболевания, перенесенные операции, наличие бактериурии до операции, вид операции («перк или мини-перк»), количество доступов и установленных нефростом после ПНЛТ, наличие резидуальных (оставленных) камней. Бактериологическое исследование мочи, уретральных катетеров и нефростом выполняли в следующие сроки:
- моча до операции, на 3 и 7 сутки;
- моча из лоханки, взятой во время ее пункции при ПНЛТ;
- уретральный катетер;
- нефростома.
В таблицу также вносили данные о наличии биопленок на катетерах по результатам исследования их в лаборатории биопленок института микробиологии им. Н.Ф. Гамалеи. Обязательно регистрировали все случаи присоединения инфекционных осложнений после операции и в течение всего периода пребывания пациента в отделении.
Вносились данные: развитие ССВР и септических осложнений, уровень прокальцитонина, необходимость в дополнительном назначении антибиотиков у пациентов, леченных препаратом пиобактериофага и, наконец, результаты долгосрочного наблюдения – через 30 дней после операции: их состояние и результаты анализов мочи (по телефонному опросу, так как большинство пациентов были иногородние).
Оценку результатов исследования проводили на основании статистического анализа и экспертной оценки. Статистический анализ результатов осуществляли с помощью программ Statistica v.10, использовали непараметрические критерии статистического анализа. Сравнительный анализ между группами проведен с помощью критерия Манна-Уитни и Хи-критерия Пирсона.
Таблица 1. Распределение больных по группам и методам лечения
| Группа I профилактическая, контрольная (n-15) |
Группа II основная, контрольная (n=15) |
Группа III профилактическая (n=15) |
Группа IV основная (n=15) |
| Пациенты с камнями почек с неинфицированной мочой (роста нет по результатам бактериологических анализов мочи) | Пациенты с камнями почек, с бактериурией по результатам бактериологических анализов мочи | Пациенты с камнями почек с неинфицированной мочой (роста нет по результатам бактериологических анализов мочи) | Пациенты с камнями почек, с бактериурией |
| Антибактериальная профилактика антибиотиком – ципрофлоксацином 1000 мг в\в капельно в течение 60 минут во время ПНЛТ. Установка катетеров, дренажей, стентов (необработанных бактериофагами). В послеоперационном периоде – антибактериальная терапия (3-5 дней) | Антибактериальная профилактика – ципрофлоксацин 1000 мг в\в капельно в течение 60 минут во время ПНЛТ. Установка катетеров, дренажей, стентов, (необработанных бактериофагами. В послеоперационном периоде – антибактериальная терапия, согласно чувствительности к антибиотикам выделенного уропатогена (3-5 дней) | Препарат пиобактериофаг применяли однократно за 2 часа до операции 40 мл перорально. Установка катетеров, дренажей, стентов, обработанных препаратом пиобактериофагом. Назначали терапию пиобактериофагом (по 40 мл 3 р. в день) после операции (3-5 дней), при наличии показаний добавляли антибиотики | Препарат пиобактериофаг применяли за 2 часа до операции 40 мл перорально. Установка катетеров, дренажей, стентов, обработанных пиобактериофагом. В послеоперационном периоде в течение 3-5 дней назначался препарат пиобактериофаг по 40 мл 3 р. в день |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Перед тем, как начать клиническую часть исследования было проведено определение резистентности выделенных микроорганизмов у урологических пациентов нашего стационара к препаратам бактериофагов (рис. 3).
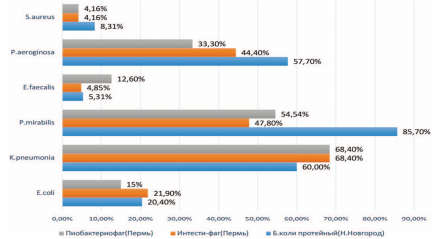
Рис. 3. Резистентность микроорганизмов к препаратм бактериофагов
Как видно из рисунка 3, наиболее устойчивыми к препаратам бактериофагов были P. aeruginosa (от 33% до 57%), P. mirabilis(от 47,8% до 85,7%), K. pneumonia (от 60% до 68%). Устойчивость E. Coli колебалась от 15 до 21%, в зависимости от препарата и производителя.
В таблице 2 перечислены микроорганизмы, которые были выделены из мочи пациентов II и IV групп до операции.
Таблица 2. Выделенные микроорганизмы из мочи пациентов до оперативного вмешательства
| Микроорганизм | Группа пациентов, получавших антибиотики (группа II) | Группа пациентов, получавших бактериофаги (группа IV) | ||
| Количество | % | Количество | % | |
| E.coli* | 11 | 73,3 | 12 | 80 |
| Klebsiella pneumoniae * | 3 | 20,0 | 1 | 6,7 |
| Streptococcus anginosus* | 1 | 6,7 | - | - |
| Providencia stuartii | - | - | 1 | 6,7 |
| Enterococcus faecalis* | - | - | 1 | 6,7 |
*- mixt инфекция
Во II группе, E.coli выделили у 11 пациентов, из них у 3 – совместно с Enterococcus faecalis; у одного пациента E. coli гемолитическая в титре 105 КОЕ/мл. Klebsiella pneumoniae обнаружена у трех пациентов, из них у двух – совместно с Enterococcus faecalis. Streptococcus anginosus вместе с Corynebacterium spp. 103 КОЕ/мл. выделили у 1 пациента. В IV группе пациентов с бактериурией E. coli выделили у 12 пациентов, из них у 1 – совместно с Enterococcus faecalis. В этой группе пациентов у всех выделенных возбудителей (E.coli, Klebsiella pneumoniae, Streptococcus anginosus) была выявлена чувствительность к препарату Пиобактериофагу поливалентному очищенному.
У пациентов I и III групп, которым также проводили периоперационную профилактику антибиотиками и фагами, в посеве мочи роста не выявлено.
До начала нашего исследования мы выделили 100 штаммов кишечной палочки из мочи урологических пациентов и отправили их в г. Пермь на фаговое производство НПО «Микроген» (являющегося единственным производителем препаратов бактериофагов в России). До подбора препаратов бактериофагов к нашим штаммам кишечной палочки антибактериальная активность пиобактериофага поливалентного была 72%. После подбора фагов из сточных вод из 12 городов (которые были получены с января по март 2017 г.) антибактериальная активность бактериофагов по Аппельману в разведении 10-4 и выше увеличилась до 92%.
При сравнительном анализе результатов посевов мочи на флору и чувствительность к антимикробным препаратам, взятых из лоханки почки во время ПНЛТ и мочи до операции, были получены результаты, представленные в таблице 3.
Таблица 3. Микроорганизмы, выделенные из лоханки почки во время ПНЛТ у пациентов различных групп
| Микроорганизм | Количество пациентов | % |
| Группа I | ||
| Роста микрофлоры не выявлено | 14 | 93,3 |
| Klebsiella pneumoniae | 1 | 6,7 |
| Группа II | ||
| Роста микрофлоры не выявлено | 5 | 33,3 |
| Enterococcus faecalis | 2 | 13,3 |
| E.coli* | 6 | 40,0 |
| Klebsiella pneumoniae* | 2 | 13,3 |
| E.coli выделилась у 6 пациентов, из них у 1 пациента вместе с Enterococcus faecalis, у 1 пациента вместе с Klebsiella pneumonia Klebsiella pneumoniae у 2 пациентов, из них у 1 пациента вместе Enterococcus faecalis | ||
| Группа III | ||
| Роста микрофлоры не выявлено | 10 | 66,7 |
| E.coli* | 4 | 26,6 |
| Morganella morganii | 1 | 6,7 |
| *Всего E.coli выделилась у 4 пациентов, из них у 1 пациента вместе с Enterococcus faecalis, у 1 пациента - вместе с Streptococcus anginosus, у 1 - вместе с Proteus mirabilis | ||
| Группа IV | ||
| Роста микрофлоры не выявлено | 7 | 46,7 |
| E.coli* | 7 | 46,7 |
| Pseudomonas aeruginosa* | 1 | 6,7 |
| *Всего E.coli выделили у 7 пациентов, из них у 2 пациентов вместе с Enterococcus faecalis, у 1 пациента - совместно со Streptococcus anginosus, у 1 - совместно с Proteus mirabilis. Pseudomonas aeroginosa выделили у 1 пациента совместно с Providencia struartii, Enterococcus faecalis | ||
Таблица 4. Сравнительный анализ данных воспалительной реакции между группами пациентов по Хи-критерию Пирсона
| Группы пациентов | Лейкоцитоз 1 сутки | Лейкоцитоз 3 сутки | Лейкоцитоз 7 сутки | П/я сдвиг 1 сутки | П/я сдвиг 3 сутки | П/я сдвиг 7 сутки | T >38°C 1 cутки | T >38°C 3 cутки | T >38°C 7 cутки | ССВР |
|---|---|---|---|---|---|---|---|---|---|---|
| I и III группы | н/р | р=0,0001 | н/р | р=0,0001 | р=0,03 | р=0,008 | н/р | н/р | н/р | н/д |
| II и IV группы | р=0,004 | р=0,004 | р<0,0001 | р<0,0001 | н/д | р<0,005 | н/д | н/р | н/р | н/д |
Таблица 5. Сравнительный анализ бактериологических результатов между группами пациентов по Хи-критерию Пирсона
| Группы пациентов | Посев мочи из лоханки почки | Посев катетера | Посев нефростомического дренажа | Посев мочи 3 сутки | Посев мочи 7 сутки |
| I и III группы | p<0,0001 | р=0,05 | р=0,05 | р<0,0001 | р<0,0001 |
| II и IV группы | р=0,05 | p<0,001 | p=0,003 | р<0,0001 | н/д |
Таблица 6. Микроорганизмы, выделенные на поверхности уретрального катетера у пациентов различных групп
| Микроорганизм | Количество пациентов | % |
|---|---|---|
| Группа I | ||
| Роста микрофлоры не выявлено | 8 | 53,3 |
| Proteus mirabilis | 1 | 6,7 |
| Staphylococcus epiderdimis | 1 | 6,7 |
| Staphylococcus haemolyticus* | 2 | 13,3 |
| Enterococcus faecalis* | 3 | 20,0 |
| Klebsiella pneumoniae* | 2 | 13,3 |
| *Klebsiella pneumoniae выделен у 2 пациентов, из них у 1 пациента вместе Enterococcus faecalis. Enterococcus faecalis - у 2 пациентов, из них у 1 вместе с Staphylococcus haemolyticus Примечание. В данной группе количество выделенных микроорганизмов превышает 15, так как были выделены несколько микроорганизмов с одного катетера (микст инфекция |
||
| Группа II | ||
| Роста микрофлоры не выявлено | 7 | 46,6 |
| Proteus mirabilis | 1 | 6,7 |
| Enterococcus faecalis* | 3 | 20,0 |
| Candida spp. | 1 | 6,7 |
| Cor.striatum* | 1 | 6,7 |
| E. coli* | 3 | 20,0 |
| Lac.spp. | 1 | 6,7 |
| Klebsiella pneumoniae | 1 | 6,7 |
| *Enterococcus faecalis выделен у 2 пациентов, из них у 1 пациента - вместе с Klebsiella pneumoniae, Cor.striatum у 1 пациента, совместно с E.coli, Lac.spp. Примечание. В данной группе количество выделенных микроорганизмов превышает 15, так как были выделены несколько микроорганизмов с одного катетера (микст инфекция) |
||
| Группа III | ||
| Роста микрофлоры не выявлено | 6 | 40,0 |
| Klebsiella pneumoniae* | 4 | 26,6 |
| Morganella | 2 | 13,3 |
| Staphylococcus agalactiae | 1 | 6,7 |
| Enterococcus faecalis* | 3 | 20,0 |
| St. aureus | 1 | 6,7 |
| *Всего E.coli выделилась у 4 пациентов, из них у 1 пациента вместе с Enterococcus faecalis, Klebsiella pneumoniae у 2 пациентов, из них у 1 пациента вместе с Enterococcus faecalis | ||
| Группа IV | ||
| Роста микрофлоры не выявлено | 3 | 20,0 |
| E.coli* | 7 | 46,7 |
| St.epidermidis* | 1 | 6,7 |
| Cor.striatum* | 1 | 6,7 |
| Enterobacter cloacae | 1 | 6,7 |
| *Всего E.coli выделили у 7 пациентов, из них у 3 пациентов вместе с Enterococcus faecalis, у 1 пациента - вместе с Enterococcus faecalis и St.epidermidis, у 1 пациента совместно с Cor.striatum Примечание. В данной группе количество выделенных микроорганизмов превышает 15, так как были выделены несколько микроорганизмов с одного катетера (микст инфекция) |
||
При сравнительном статистическом анализе по различию между группами I-III и II-IV по критерию Хи-квадрат Пирсона получены достоверные различия в группах I и III (р< 0,0001), между группами II и IV достоверных различий не получено. Таким образом, антибактериальная профилактика у пациентов со стерильной мочой перед операцией имеет преимущества перед бактериофагопрофилактикой в плане «стерильности» мочи во время операции.
По результатам исследований катетеров в НИЦ эпидемиологии и микробиологии им. Н.Ф. Гамалеи по факту наличия бактериального роста (наличие биопленки) на кусочках удаленных от пациентов катетеров было показано, что на большинстве клинических образцах катетеров были сформированы бактериальные пленки (в 63,4% – при фагопрофилактике и в 70% – при антибиотикопрофилактике, р=0,32).
Результаты клинического исследования
При сравнительном анализе данных 4-х групп пациентов по разным показателям проводили статистический анализ по различию между группами по критерию Хи-квадрат Пирсона. Сравнивали данные лейкоцитоза, палочкоядерного сдвига, гипертермии после ПНЛТ на 1, 3, 7 сутки между 1 и 3 группами пациентов, у которых не обнаружено роста микроорганизмов в моче перед операцией и которым профилактически назначали либо антибиотики (группа I), либо бактериофаги (группа III). Пациенты с бактериурией перед ПНЛТ, которым также проводили антимикробную профилактику перед ПНЛТ либо антибиотиком (группа II), либо бактериофагом (группа IV) – сравнивали между собой по тем же показателям (табл. 4).
Таким образом, при оценке таких показателей, как лейкоцитоз после ПНЛТ, в группе I и III,где в моче пациентов перед операцией не было выявлено роста, мы не обнаружили различий на 1 и 7 сутки после операции, тогда как по показателю палочкоядерный сдвиг вформуле крови достоверно сдвиг был больше в группе, получавшей препараты бактериофагов.
По гипертермии после ПНЛТ во всех группах не выявлено различий, а к 7 суткам в обеих группах температура тела нормализовалась. По частоте развития ССВР (наличие ≥2 признаков воспаления) между I и III группами пациентов не обнаружено различий, тогда как в группе III у одного пациента в послеоперационном периоде развился острый пиелонефрит, что потребовало добавления антибактериальной терапии.
При сравнении данных между группами II и IV (т.е. пациенты с бактериурией перед операцией), по таким показателям, как лейкоцитоз и палочкоядерный сдвиг, после ПНЛТ на 1-е, 3-и и 7-е сутки показатели более выражены в группе, получавшей бактериофаги. В то же время, по показателю гипертермия не выявлено различий; более того, в обеих группах к 7-м суткам температура тела нормализовалась. По ССВР разницы между 2-мя группами не получено (р<0,004).
Сравнительный анализ бактериологических результатов мочи, катетеров, нефростомических дренажей между группами представлен в таблице 5.
Таким образом, данные бактериологических исследований мочи показывают, что бактериофаги «работают» несколько медленнее, чем антибиотики. Только в группе пациентов с предоперационной бактериурией на 7 сутки после ПНЛТ не получено достоверных различий в результатах бактериологического исследования мочи в обеих группах пациентов. В таблице 6 представлены бактериологические данные по уретральным катетерам, удаленным в 1 сутки после ПНЛТ.
При сравнительном анализе бактериологических результатов уретральных катетеров между группами пациентов по Хи-критерию Пирсона между группами I и III получена тенденция к статистической достоверности р=0,059, а различия между группами II и IV статистически достоверны (р<0,0001). Таким образом, кратковременная (30 минут) обработка уретральных катетеров препаратами бактериофагов и фаготерапия не снижают контаминацию катетеров микроорганизмами, также как и применение антибиотиков.
Таблица 7. Микроорганизмы, выделенные с поверхности нефростомических дренажей в различных группах больных
| Микроорганизм | Количество пациентов | % |
| Группа I | ||
| Роста микрофлоры не выявлено | 8 | 53 |
| Pseudomonas aeruginosa | 2 | 13,3 |
| Staphylococcus hominis | 1 | 6,7 |
| Klebsiella pneumoniae | 2 | 13,3 |
| Staphylococcus haemoliticus | 1 | 6,7 |
| Enterococcus faecalis | 1 | 6,7 |
| Группа II (n-13) | ||
| Роста микрофлоры не выявлено | 7 | 46,6 |
| Enterococcus faecalis* | 1 | 6,7 |
| E. coli* | 3 | 20,0 |
| Klebsiella pneumoniae* | 1 | 6,7 |
| Candida albicans | 1 | 6,7 |
| Escherichia coli всего выделен у 3 пациентов, из них у 2 - вместе с Enterococcus faecalis. Enterococcus faecalis всего выделился у 4 пациентов, из них у 2 - с Escherichia coli. Примечание 1: Общее количество выделенных микроорганизмов превышает 13, так как отмечалась микст инфекция. Примечание 2: В группе количество исследуемых нефростомических дренажей 13, так как 2 пациента были выписаны с функционирующими нефростомическими дренажами. |
||
| Группа III (n=13) | ||
| Роста микрофлоры не выявлено | 2 | 15,3 |
| Staphylococcus epidermidis | 1 | 7,6 |
| Klebsiella pneumoniae* | 1 | 7,6 |
| St. aureus | 3 | 23,0 |
| Acinetobacter baumannii | 1 | 7,6 |
| Enterococcus faecalis* | 1 | 7,6 |
| Corynebacterium spp. | 1 | 7,6 |
| Proteus mirabilis | 1 | 7,6 |
| В группе количество исследуемых нефростомических дренажей 13, так как 2 пациента были выписаны с функционирующими нефростомическими дренажами | ||
| Группа IV | ||
| Роста микрофлоры не выявлено | 8 | 61,5 |
| Staphylococcus epidermidis | 1 | 7,6 |
| Escherichia coli* | 2 | 15,3 |
| Pseudomonas aeruginosa | 1 | 7,6 |
| Enterococcus faecalis* | 1 | 7,6 |
| Escherichia coli всего выделенау 2 пациентов, из них у 1-вместе с Enterococcus faecalis. Enterococcus faecalis выделился у 1 пациента вместе с Escherichia coli. Примечание 1: Общее количество выделенных микроорганизмов превышает 13, так как отмечалась микст инфекция. Примечание 2: В группе пациентов получающих профилактику и лечение антибиотиками с бактериурией количество исследуемых нефростомических дренажей 13, так как 2 пациента были выписаны с функционирующими нефростомическими дренажами |
||
В таблице 7 представлены данные по выделенным микроорганизмам с поверхности нефростомических дренажей, как обработанных, так и необработанных препаратом Пиобактериофага в течение 30 минут до ПНЛТ.
При сравнительном анализе данных групп I и III, а также II и IV, используя критерий ХИ- квадрат Пирсона, данные отличаются достоверно (р<0,001).
При сравнении среднего койко/дня в 2-х группах пациентов, леченных бактериофагами или антибиотиками не получено статистической разницы (11,3 vs 10,48 р=0,86).
Есть достоверные отличия только при анализе сопряженности таких показателей, как почечная недостаточность и развитие ССВР в случае применения антибиотиков. При сравнительном анализе между объединёнными группами (получавшие антибиотики и получавшие бактериофаги) с помощью критерия Манна-Уитни нет достоверности в отличиях между группами по таким показателям, как лейкоцитоз, палочкоядерный сдвиг, гипертермия.
Таким образом, в целом, антибактериальная профилактика и бактериофагопрофилактика показали одинаковый эффект. Влияние какого либофактора на развитие инфекционно-воспалительных осложнений ИВО после операции не доказано из-за малой выборки данных, но, например, влияние множественных камней на ИВО может при большой выборке оказаться достоверным, т.к. в настоящем исследовании р= 0,06.
Через 30 дней после выписки пациентов из клиники (проводили телефонный опрос, так как большинство пациентов были иногородними). В группе, получавшей антибиотики, у одного пациента за это время была проведена повторная операция по поводу резидуального камня почки. В обеих группах отмечалась бактериурия по данным клинического анализа мочи: в I группе пациентов у 18,75%, в III группе – у 13,3%. В тоже время как во II группе бактериурия была в 26,6%, а в IV – у 20% пациентов. При сравнительном анализе статистической достоверности различий этого показателя между группами c применением бактериофагов и без них не получено.
ВЫВОДЫ
Препарат пиобактериофаг поливалентный очищенный может применяться с целью профилактики и лечения инфекционновоспалительных осложнений при ПНЛТ, как альтернатива антибактериальной профилактике, что имеет большое значение в условиях роста антибиотикорезистентных возбудителей.
По таким показателям, как повышение температуры тела после операции на 1, 3, 7 сутки, а также по развитию синдрома системной воспалительной реакции достоверных различий не получено. Более того, к 7-м суткам показатели крови (лейкоциты и палочкоядерные нейтрофилы) пришли к нормальным значениям во всех 4-х группах, что свидетельствует о равной эффективности как антибиотиков, так и бактериофагов.
Для улучшения антимикробного действия необходим постоянный мониторинг чувствительности микроорганизмов к препаратам бактериофагов и постоянный подбор (адаптация) препаратов бактериофагов к возбудителям урологических инфекций.
ЛИТЕРАТУРА
- Michel MS, Trojan L, Rassweiler JJ. Complications in percutaneous nephrolithotomy. Eur Urol 2007;51(4):899-906.
- Kreydin, EI, Eisner BH. Risk factors for sepsis after percutaneous renal stone surgery. Nat Rev Urol 2013;10(10):598-605. doi:10.1038/nrurol.2013.183
- Rivera M, Viers B, Cockerill P, Agarwal D, Mehta R, Krambeck AJ. Pre- and postoperative predictors of infection-related complications in patients undergoing percutaneous nephrolithotomy. Endourol 2016;30(9):982-6. doi: 10.1089/end.2016.0191.
- Liu Yu-qing, Lu Jian, HAO Yi-chang, XIAO Chun-lei, MA Lu-lin. Predicting model based on risk factors for urosepsis after percutaneous nephrolithotomy. J Peking University 2018;50(3):507-513
- Bolomytis S, Harding R, Timoney A, Keeley F, Jacobson K, Collin N, Philip J. PCNL SIRS risk increasing in patientswith positive stone culture and suboptimalrenal drainage. Bristol Urological Institute, EAU, 2018. Poster 325
- Bonkat G, Pickard R, Bartoletti R., Cai T, Bruyère F, Geerlings SE, et al. Guidelines EAU. Urological Infections. URL: https://uroweb.org/guideline/urological-infections/
- Seyrek M, Binbay M, Yuruk E, Akman T, Aslan R, Yazici O, et al. Perioperative prophylaxis for percutaneous nephrolithotomy: Randomized study concerning the drug and dosage. J Endourol 2012;26(11):1431-6. doi: 10.1089/end.2012.0242.
- Tuzel E., Aktepe OC, Akdogan B. Prospective comparative study of two protocols of antibiotic prophylaxis in percutaneous nephrolithotomy. J Endourol 2013;27(2):172-6. doi: 10.1089/end.2012.0331.
Статья опубликована в журнале "Экспериментанльная и клиническая урология" №1 2019, стр. 132-138