Ю.Л. Набока, И.А. Гудима, К.Т. Джалагония, М.Л.Черницкая, С.Н. Иванов
ФГБОУ ВО «Ростовский государственный медицинский университет» МЗ РФ; Ростов-на-Дону, Россия
Введение
Распространённость инфекций мочевых путей (ИМП) в целом и рецидивирующей инфекции нижних мочевых путей (РИНМП), в частности остаётся на постоянном высоком уровне. Многие факты этой проблемы лишь констатируются, например, что в среднем 20,0% женщин до 30 лет в анамнезе имели определённое количество или хотя бы один эпизод цистита, а из них у 10,0% регистрируют рецидивы заболевания [1]. А в течение всей жизни практически 50,0% женщин отмечают один или несколько эпизодов манифестации заболевания и 2/3 по этому поводу принимают различные антибактериальные препараты [2]. Большая когорта женщин (46,0%) занимаются самолечением [3]. Проблема, на наш взгляд, столь глубока, что недаром во всех клинических рекомендациях РОУ последних лет красной нитью проходит фраза об отсутствии стратегической точки зрения, некого консенсуса по введению данной когорты [4] пациентов. Изучение микробиоты мочевых путей не вошли в проекты по изучению данной проблемы, что связано с парадигмой о стерильности мочи, абсолютно узким изучением данного биотопа вне связи с микробными паттернами макроорганизма, в частности толстого кишечника, и стагнацией в изучении этиологической структуры заболевания.
Цель исследования. Изучить микробиоту мочи и толстого кишечника, а также значимых корреляционных связей в данных биотопах.
Материалы и методы
На базах урологического отделения и клиники урологии и кафедры микробиологии, и вирусологии №1 РостГМУ были обследованы 169 пациенток с РНИНМП, средний возраст которых составил 36,2±4,7 лет. Критерии включения в данное исследование: клинические проявления РНИНМП из данных анамнеза, наличие 3 обострений в год или 2-3 в течение полугода, отсутствие инфекций, передающихся половым путём, пролапса гениталий, согласие пациенток на участие в исследование.
Мочу для бактериологического исследования забирали в соответствии с правилами, изложенными в Клинических рекомендациях (2014) строго соблюдая преаналитический этап. Для сбора мочи использовали контейнер Sterile Uricol фирмы «HiMedia». Посев мочи проводили на среды, регламентированные в Клинических рекомендациях [5], но несколько расширив их спектр [6]. Посевы мочи культивировали в аэробных (температура 370 С, 24 часа) и анаэробных (AnaeroHiGas Pak, температура 370 С) условиях. Идентификацию выделенных из мочи микроорганизмов проводили по общепринятым методикам.
Исследование микробиоты толстого кишечника, а также забор материала проводили в соответствии с правилами, изложенными в отраслевом стандарте (ОС) ОСТ 915000. 11.0004 – 2003, Приказ МЗ РФ №231 от 09.09.3 [7]. Соответственно, руководствуясь данным стандартом, проводили интерпретацию полученных результатов.
Статистическая обработка полученных результатов реализована с использованием пакета SPSS версии 23. Сравнение количественных характеристик микроорганизмов проводили с применением t-критерия равенства, а также критерия Манна-Уитни. Обнаружение значимых связей между количественными характеристиками микроорганизмов, выделенными из мочи и толстого кишечника, выявляли, используя коэффициент корреляции Спирмена. Значимые корреляционные связи между частотами обнаружения микроорганизмов определяли, используя коэффициент взаимной сопряжённости (КВС).
Результаты и обсуждение
У пациенток с РНИНМП из представителей семейства Enterobacteriaceae в моче преобладали E. coli (55,6%) и, в порядке убывания, спектр энтеробактерий был представлен Klebsiella spp., Enterobacter spp., Proteus spp., H. alvei, M. morganii, Citrobacter spp., Aeromonas spp. (табл. 1).
Таблица 1. Частоты обнаружения и количественные характеристики микроорганизмов в моче пациенток с РНИНМП
| Микроорганизмы | Частота обнаружения (%) | Среднее | Медиана | Мода | Стд. отклонение | Минимум | Максимум |
| E. coli | 55,6 | 4,9 | 5 | 5,5 | 1,4 | 2 | 8 |
| Klebsiella spp. | 10,1 | 3,9 | 3,3 | 2,5 | 1,8 | 2 | 7 |
| Enterobacter spp. | 6,5 | 3,9 | 4 | 4 | 1,7 | 2 | 6 |
| Proteus spp. | 6,5 | 4,1 | 4,3 | 4 | 1,8 | 2 | 6 |
| M. morganii | 0,6 | 4,3 | 4,5 | 2,0* | 3,5 | 2 | 7 |
| Citrobacter spp. | 0,6 | 8 | 8 | 8 | - | 8 | 8 |
| Aeromonas spp. | 0,6 | 7 | 7 | 7 | - | 7 | 7 |
| H. alvei | 1,2 | 4 | 4 | 2,0* | 2,8 | 2 | 6 |
| P. aeruginosa | 6,5 | 4 | 4,3 | 5 | 1,2 | 2 | 5 |
| Acinetobacter spp. | 0,6 | 4 | 4 | 4 | - | 4 | 4 |
| CoNS | 60,9 | 2,3 | 2 | 2 | 0,8 | 2 | 6 |
| Enterococcus spp. | 52,7 | 2,8 | 2 | 2 | 1,3 | 2 | 7 |
| Corynebacterium spp. | 41,4 | 2,4 | 2 | 2 | 0,7 | 2 | 5 |
| S. aureus | 9,5 | 2,6 | 2 | 2 | 0,9 | 2 | 6 |
| Bacillus spp. | 2,4 | 2 | 2 | 2 | 0 | 2 | 2 |
| Micrococcus spp. | 3 | 2 | 2 | 2 | 0 | 2 | 2 |
| Streptococcus spp. | 0,6 | 2 | 2 | 2 | - | 2 | 2 |
| Candida spp. | 10,1 | 2,3 | 2 | 2 | 0,8 | 2 | 5 |
| Lactobacillus spp. | 53,3 | 2,2 | 2 | 2 | 0,4 | 2 | 3 |
| Eubacterium spp. | 40,8 | 2,8 | 2,3 | 2 | 1Д | 2 | 5 |
| Peptococcus spp. | 33,7 | 2,2 | 2 | 2 | 0,5 | 2 | 5 |
| Propionibacterium spp. | 38,5 | 2,3 | 2 | 2 | 0,7 | 2 | 6 |
| Bacteroides spp. | 19,5 | 2,1 | 2 | 2 | 0,4 | 2 | 4 |
| Peptostreptococcus spp. | 18,3 | 2,1 | 2 | 2 | 0,3 | 2 | 3 |
| Mobiluncus spp. | 5,3 | 2,1 | 2 | 2 | 0,3 | 2 | 3 |
| Veillonnella spp. | 17,2 | 2,3 | 2 | 2 | 0,7 | 2 | 5 |
| Fusobacterium spp. | 11,8 | 2,2 | 2 | 2 | 0,4 | 2 | 3 |
| Megasphaera spp. | 14,8 | 2,2 | 2 | 2 | 0,6 | 2 | 5 |
| Prevotella spp. | 7,7 | 2,2 | 2 | 2 | 0,5 | 2 | 3 |
| Bifidobacterium spp. | 13 | 2,1 | 2 | 2 | 0,3 | 2 | 3 |
| Actinomyces spp. | 0,6 | 4 | 4 | 4 | - | 4 | 4 |
Из представителей грампозитивной микрофлоры из мочи чаще выделяли коагулазоотрицательные стафилококки (КОС), Enterococcus spp. и Corynebacterium spp. (60,9%, 52,7% и 41,4% соответственно). Дрожжеподобные грибы рода Candida spp. выделены из мочи у 10,1% пациентов. В группе неклостридиально-анаэробных бактерий верифицировали 13 таксонов с преобладанием Lactobacillus spp. (53,3%) и Eubacterium spp. (40,8%). Практически у 1/3 пациенток в моче обнаруживали Peptococcus spp. (33,7%) и Propionibacterium spp. (38,5%).
Средние значения уровня бактериурии для многих таксонов были ниже диагностически значимого (≥103 КОЕ/мл). Но, несмотря на это, верхний размах бактериурии был ≥103 КОЕ/мл для большинства родов за исключением Bacillus spp., Micrococcus spp., Streptococcus spp.
35 пациенткам с данной патологией одновременно с микробиотой мочи была исследована микробиота толстого кишечника. В ОС приведены лишь количественные показатели микроорганизмов, в дополнение к этому были также определены частоты обнаружения различных таксонов микробиоты (рис. 1).
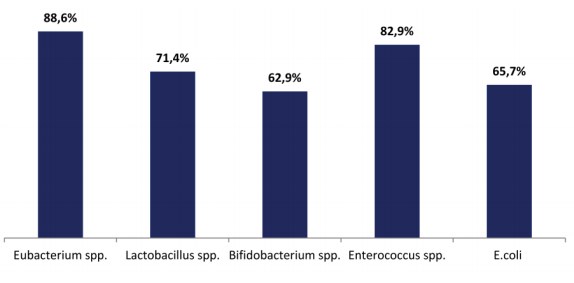
Рисунок 1. Доминирующие таксоны микробиоты толстого кишечника у пациенток с РНИНМП
Втолстомкишечникебольных РНИНМПдоминировали Eubacterium spp. (88,6%) и Enterococcus spp. (82,9%). Было проведено сравнение концентрации выделенных микроорганизмов с показателями Отраслевого Стандарта (табл. 2).
Таблица 2. Результаты сравнения среднего количества (lg КОЕ/т) микроорганизмов, выделенных из толстого кишечника пациенток с РНИНМП в сопоставлении с показателями отраслевого стандарта
| Микроорганизмы | Среднее | Отраслевой стандарт | Стд. отклонение | t-статистика |
| Bifidobacterium spp. | 5 | 9-10 | 0,8 | 30,1* |
| Lactobacillus spp. | 2,8 | 8 | 0,7 | 19,3* |
| Bacteroides spp. | 8,3 | 8 | 1,1 | 23,8* |
| Fusobacterium spp. | 5,6 | 7-10 | 1,1 | 13,9* |
| Eubacterium spp. | 4,8 | 7-10 | 0,8 | 31,7* |
| Peptostreptococcus spp. | 6,3 | 9-10 | 1,5 | 15,8* |
| Enterococcus spp. | 5,2 | 7-8 | 1 | 27,4* |
| E. coli | 4,2 | 7,5 | 1,8 | 13,2* |
| E. coli гемолитические / hemolytic | 5,2 | 0 | 1,3 | 0 |
| E. coli лактозонегативные /lactose-negative | 5,1 | <5 | 1,3 | 8,0 |
| Klebsiella spp. | 4,3 | <5 | 0,8 | 21,3* |
| Enterobacter spp. | 4,4 | 4-5 | 1,6 | 3,1 |
| Proteus spp. | 5 | 4-5 | 2,6 | 3,4 |
| CoNS | 4,2 | 4-5 | 1,7 | 4,1 |
| Candida spp. | 4 | <4 | 0,9 | 19,3* |
| 4,0 | <4 | 1,3 | 3,3 |
Примечания: * различия значимы на 1% уровне, (p<0,01)
По сравнению с формально – нормативными показателями у пациенток с РНИНМП были значимо снижены практически все изучаемые показатели за исключением некоторых таксонов.
Таким образом, РНИНМП сопровождается характерными и глубокими дисбиотическими изменениями в микробиоте толстого кишечника.
Были проанализированы значимые корреляционные связи между микроорганизмами, обнаруженными в моче и фекалиях пациенток с РНИНМП. Сравнение проводилось по двум признакам: количеству и частотам обнаружения.
По количественному признаку регистрировали два значимых коэффициента корреляции. Один обратный между типичными E. coli, выделенными из мочи, и Eubacterium spp., выделенными из фекалий (г=-0,434, p=0,009). Данный коэффициент корреляции свидетельствует о том, что при увеличении в моче количества типичных E. coli, в кишечнике снижается количество Eubacterium spp. Второй значимый коэффициент корреляции был прямым между количеством лактобацилл, выделенных из мочи и КОС, выделенных из фекалий.
При сравнении частот обнаружения различных таксонов микробиоты в изучаемых локусах обнаружены три значимых КВС: между лактобациллами или пептококками, выделенными из мочи и КОС, верифицированными в фекалиях (КВС – 0,342, p=0,031 и КВС – 0,341, p=0,018 соответственно), а также между пептококками обнаруженными в моче и энтерококками – в фекалиях (КВС – 0,349, p=0,028).
Вследствие того, что пациенты с РНИНМП являются наиболее сложной когортой больных в плане лечения, а проводимая антибактериальная терапия не всегда эффективна, необходимо несколько изменить вектор изучения данной проблемы. На наш взгляд, наиболее перспективным направлением является изучение не только микробиоты мочи при РНИНМП, но и микробиоты наиболее массивного по качественному и количественному разнообразию биотопа – толстого кишечника. Бесспорно, не только нами, но и другими исследователями предпринимаются попытки в этом направлении. Наиболее «элегантными» отечественными исследованиями, объясняющими патогенез ИМП с микробиологических позиций и с точки зрения эндогенного инфицирования органов мочевой системы являются работы В.А. Гриценко с соавт. [8]. Другими исследователями также предприняты попытки изучения транслокационного механизма миграции микроорганизмов из толстого кишечника в органы мочевой системы. Авторы приходят к заключению, что уропатогенные кишечные палочки из толстого кишечника успешно колонизируют мочевой пузырь и, что здоровые женщины, которые не имели эпизодов ИМП в моче содержали фекальные изоляты E. coli, которые в целом были тесно связаны по геномному паттерну с E. coli, выделенной при ИМП и фекальными изолятами, выделенными также от пациенток с ИМП [9].
Hsu C.R. et al. [10] уже при исследовании патогенеза ИМП, вызванного K. pneumoniae также приходят к выводу о транслокации данного микроорганизма из толстого кишечника. Данная работа является экспериментальной. Авторы изучали транслокационный механизм на клеточных линиях толстой кишки человека с визуализацией микроорганизмов с помощью конфокальной микроскопии и трёхмерной (3D) визуализации. В работе [Pool N.N. et al., 2017] [11] изучались вопросы предполагаемых рецепторов при транслокации микроорганизмов из кишечника, авторы предполагают, что в случае транслокации уропатогенной E. coli – это уроплакины, которые специфичны для уротелия.
Выводы
Полученные нами данные о значимых коэффициентах корреляции между микроорганизмами, выделенными из мочи и толстого кишечника, косвенно подтверждают транслокационный механизм. Бесспорно, необходимы дальнейшие исследования по транслокации микроорганизмов из кишечника и других биотопов в органы мочевой системы для понимания патогенеза этой распространённой группы заболевания.
ЛИТЕРАТУРА
- Köves B, Wullt B. The role of the host and the pathogens in urinary tract infection. Eur Urology Suppl. 2016;15:88-94. DOI: 10.1016/j.eursup.2016.04.005
- Cardwell SM, Crandon JL, Nicolau DP, McClure MH, Nailor MD. Epidemiology and economics of adult patients hospitalized with urinary tract infections. Hosp Pract. 2016;44(1):33- 40. DOI: 10.1080/21548331.2016.1133214
- Hamada Y, Magarifuchi H, Oho M, Kusaba K, Nagasawa Z, Fukuoka M, Yamakuchi H, Urakami T, Aoki Y. Clinical features of enterococcal bacteremia due to ampicillin-susceptible and ampicillin-resistant enterococci: An eight-year retrospective comparison study. Journal of Infection and Chemotherapy. 2015;21(7):527-30. DOI: 10.1016/j.jiac.2015.04.001
- Федеральные клинические рекомендации «Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов” Под ред. Аляева Ю.Г., Аполихина О.И., Пушкаря Д.Ю. [и др.] М.; 2015, 2017.
- Клинические рекомендации «Бактериологический анализ мочи» М.; 2014.
- Патент РФ № 2452773 «Способ определения бактериологической обсемененности мочи, секрета предстательной железы, эякулята» (Бюл. №16, 2012 г.). Авторы: Набока Ю.Л., Коган М.И., Гудима И.А. [и др.].
- Отраслевой стандарт «Протокол ведения больных. Дисбактериоз кишечника» (ОСТ 91500.11.0004-2003). – М., 2003.
- Вялкова А.А., Гриценко В.А. Инфекция мочевой системы у детей: современные аспекты этиологической диагностики и лечения. Рос. вестн. перинатологии и педиатрии. 2017 62(1): 99-108. DOI: 10.21508 / 1027-4065- 2017-62-1-99-108.
- Nielsen KL, Stegger M, Kiil K, Godfrey PA, Feldgarden M, Lilje B, Andersen PS, Frimodt-Møller N. Whole-genome comparison of urinary pathogenic Escherichia coli and faecal isolates of UTI patients and healthy controls. Int J Med Microbiol. 2017;307(8):497-507. DOI: 10.1016/j.ijmm.2017.09.007
- Hsu CR, Pan YJ, Liu JY, Chen CT, Lin TL, Wang JT. Klebsiella pneumoniae translocates across the intestinal epithelium via Rho GTPase- and phosphatidylinositol 3-kinase/Akt-dependent cell invasion. Infect Immun. 2015;83(2):769-779. DOI: 10.1128/IAI.02345-14
- Poole NM, Green SI, Rajan A, Vela LE, Zeng XL, Estes MK, Maresso AW. Role for FimH in Extraintestinal Pathogenic Escherichia coli Invasion and Translocation through the Intestinal Epithelium. Infect Immun. 2017;85(11):e00581-17. DOI: 10.1128/IAI.00581-17
Статья опубликована в журнале "Вестник урологии" №2 2019, стр. 59-65