Стрельцова О.С., Киселева Е.Б., Молви М.А., Лазукин В.Ф.,
Сведения об авторах:
- Стрельцова О.С. – д.м.н., профессор кафедры урологии им. Е.В. Шахова ФГБОУ ВО «ПИМУ» Минздрава России, strelzova_uro@mail.ru, AuthorID 931133
- Киселева Е.Б. – к.б.н., с.н.с. Лаборатории оптической когерентной томографии, НИИ Экспериментальной онкологии и биомедицинских технологий, ФГБОУ ВО «ПИМУ» Минздрава России, kiseleva84@gmail.com, AuthorID 625160
- Молви М.А. – аспирант кафедры урологии им. Е.В. Шахова ФГБОУ ВО «ПИМУ»Минздрава России, msmolvi@mail.ru
- Лазукин В.Ф. – к.б.н., доцент кафедры медицинской физики и информатики ФГБОУ ВО «ПИМУ» Минздрава России, valery-laz@yandex.ru, AuthorID 221079
До 30% женщин всех возрастов предъявляют жалобы на боли в области уретры, малого таза, дискомфорт при мочеиспускании, половой жизни [1]. Считают, что дизурия у них в 40% случаев обусловлена уретритом и уретральным синдромом [2]. Проблема разнообразных расстройств у женщин при неизмененных анализах мочи и отсутствии других клинических проявлений является сложной и до конца нерешенной. Не угрожая жизни больных, эти состояния вызывают тяжелые физические и моральные страдания, нередко приводят к стойкой утрате трудоспособности и инвалидизации [3].
Термин «уретральный синдром» был предложен М.Е. Stewans в 1923 году. Автор полагал, что в основе симптомокомплекса лежат стенотические процессы в уретре (хронический уретрит, парауретральный фиброз, парауретральная киста, сужение дистального отдела уретры, полипы и пролапсы слизистой оболочки уретры). Затем наблюдалась расширительная тенденция в трактовке уретрального синдрома. К нему стали относить инфекционные, травматические, нервно-психические, гормональные факторы, а также аллергию, витаминную недостаточность, уретральный спазм, влагалищную метаплазию и другие. В 2002 году термин «уретральный болевой синдром» (УБС) был принят Международным обществом по проблемам недержания мочи (International Continence Society – ICS) для того, чтобы описать возникновение рецидивирующей эпизодической уретральной боли в процессе дневных и/или ночных мочеиспусканий, при отсутствии доказанной инфекции и с частым проявлением диспареунии [4].
В клинических рекомендациях Европейской Ассоциации Урологов (European Association of Urology – EAU) 2017 г. отмечено, что УБС является частью комплекса хронической тазовой боли [5]. УБС характеризуется появлением персистирующей или рецидивирующей боли в уретре при отсутствии подтвержденной инфекции и других очевидных местных патологических изменений. Причины возникновения данной патологии остаются неясными, четкие рекомендации к профилактике и лечению УБС также отсутствуют. Современные подходы к диагностике и мониторингу патологических состояний различного генеза предполагают наличие информационно-технологической поддержки процесса диагностики и сопровождения лечения на основе численного анализа медицинских изображений, полученных с помощью разнообразных методов визуализации.
Особое значение имеет данный подход в случае заболеваний, которые проявляются субъективными симптомами (жалобами пациента) и не дают четких проявлений в виде объективных симптомов, изменений лабораторных показателей и медицинских изображений. Именно к этой группе заболеваний относятся такие патологические состояния как УБС и синдром болезненного мочевого пузыря [6]. УБС – это полиэтиологическое заболевание, требующее мультимодального подхода к анализу состояния нижних мочевых путей у женщин. Важно, что уретра, несмотря на доступность, в широкой урологической практике остается недостаточно обследованным органом. При широко применяемом методе исследования нижних мочевых путей – цистоскопии, уретра остается не осмотренной.
Уникальным современным методом неинвазивного исследования структуры тканей является метод оптической когерентной томографии (ОКТ), имеющий разрешение, близкое к клеточному (порядка 10-15 мкм). Метод основан на приеме обратно рассеянного тканью лазерного излучения ближнего инфракрасного диапазона (800-1300 нм), что дает возможность оценить состояние биологических тканей на глубину до 2 мм. Использование в качестве зондирующего излучения поляризованного света в варианте кросс-поляризационной ОКТ (КП ОКТ) позволяет оценить состояние определенных структур ткани, например, коллагена в соединительнотканном матриксе мочевого пузыря, что показано нашей исследовательской группой во множестве работ [7,8]. Цель работы: Выявить особенности состояния уретры методом КП ОКТ у больных с УБС.
МАТЕРИАЛЫ И МЕТОДЫ
Состояние уретры изучено у 69 пациенток: из них 23 с УБС (группа «УБС»), не имеющих клинических проявлений воспаления; 37 – с воспалительными заболеваниями нижних мочевых путей инфекционного генеза (группа «В»); у 9 пациенток с камнями верхних мочевых путей без явлений пиелонефрита уретра принята за норму (группа «Н»). Возраст пациенток составил от 27 до 65 лет. Всем выполняли клинический минимум исследований, включающий анализ крови, мочи, посев мочи на флору, ультразвуковое исследование (УЗИ) мочевых путей; осмотр на гинекологическом кресле наружного отверстия уретры, пальпацию уретры через переднюю стенку влагалища, пальпацию стенок влагалища, пробу О´Доннела – Хиршхорна; цистоскопию с исследованием задней стенки мочевого пузыря, мочепузырного треугольника, шейки мочевого пузыря, а также уретры методом КП ОКТ.
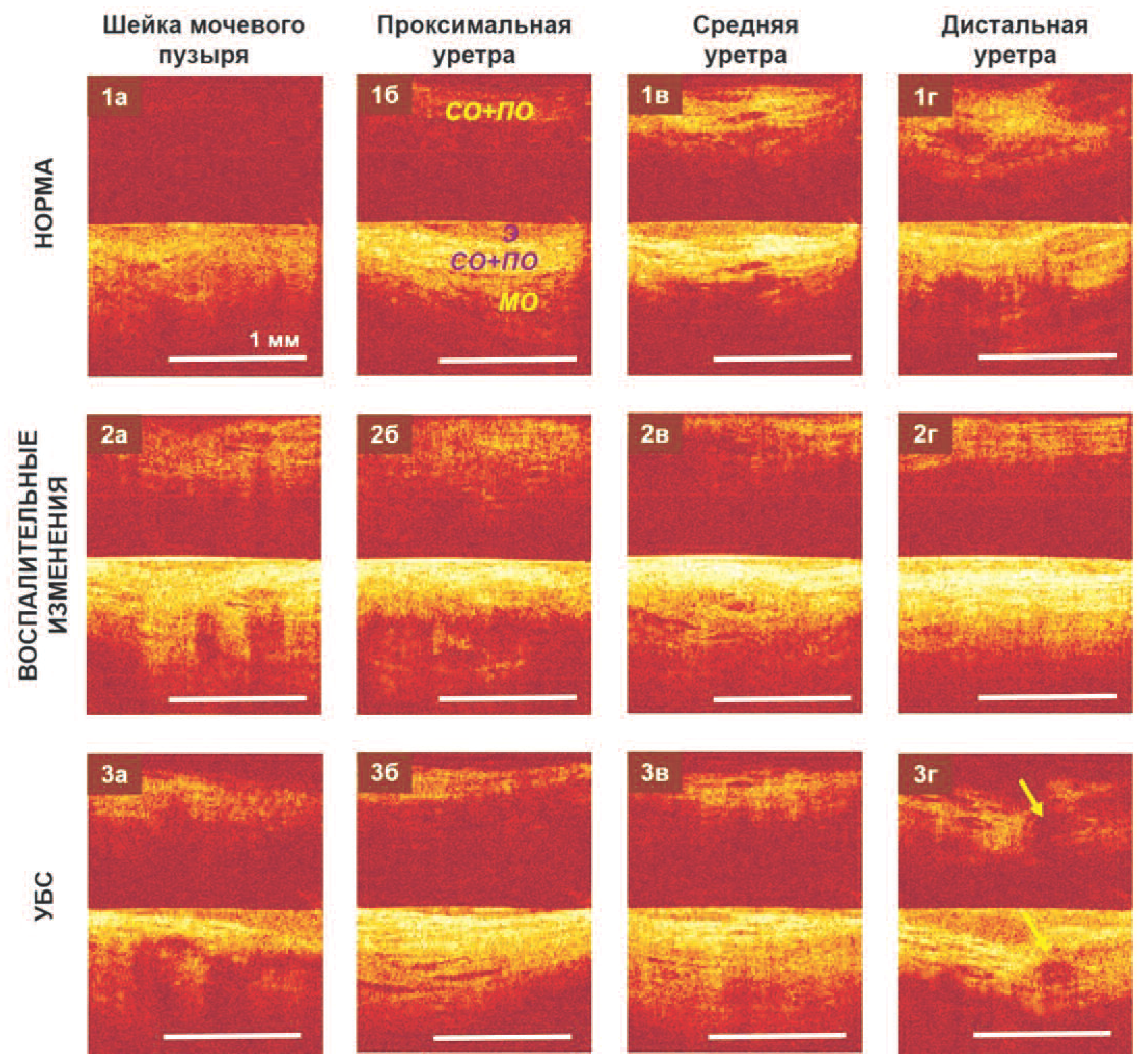
Рис. 1. КП ОКТ изображения сегментов уретры в исследуемых группах: 1 ряд – норма, 2 ряд - воспалительные изменения, 3 ряд – УБС. Нижняя часть каждого КП ОКТ изображения соответствует ко-поляризации, верхняя часть изображения - кросс-поляризации. Э – эпителий, СО – слизистая оболочка, ПО – подслизистая оболочка, МО – мышечная оболочка. Желтые стрелки указывают на расширенные выводные протоки желез
Fig. 1. CP OCT images of urethral segments in the studied groups: 1st row - normal, 2nd row - inflammatory changes, 3rd row - UPS. The lower part of each CP OCT image corresponds to co-polarization, the upper part of the image corresponds to cross-polarization. E - epithelium, CO - mucous membrane, PO - submucosal membrane, MO - muscle membrane. Yellow arrows indicate the expanded excretory ducts of the glands
Всего получено 396 КП ОКТ изображений уретры больных (в среднем 5-8 КП ОКТ изображений у каждой пациентки). В работе использован прибор «ОКТ–1300У», работающий на длине волны 1300 нм и обеспечивающий получение изображений размером 1,7 (ширина) х 2,4 (высота) мм. Каждое изображение состоит из двух частей: на нижнем изображении (в ко-поляризации) видна общая слоистая структура ткани, сигнал на верхнем изображении (в кросс-поляризации) появляется только в случае наличия в ткани анизотропных компонентов (коллагеновых и эластических волокон). По нижнему изображению легче судить о состоянии эпителия (определять норму, атрофию, дисплазию и малигнизацию). Состояние подэпителиальных слоев (слизистого и подслизистого) проще оценить по характеру и интенсивности сигнала на верхнем изображении, что позволяет выявлять признаки воспаления, фиброза, опухолевого перерождения и другие состояния ткани.
Благодаря наличию гибкого эндоскопического зонда с внешним диаметром 2,7 мм, исследование тканей мочевого пузыря и уретры проводили одновременно с цистоскопией через рабочий канал цистоскопа («Karl Storz», Germany) размером 8 Ch. Следует отметить, что для исследования структуры тканей уретры метод использовали впервые в мире. Метод уже зарекомендовал себя в урологии, гастроэнтерологии, стоматологии, гинекологии как диагностический инструмент при оценке структуры слизистых оболочек [9-11], поэтому есть все основания использовать его для прижизненного прицельного изучения эпителиальной и соединительнотканной составляющих стенки уретры. В данном исследовании гистологического подтверждения нет. На полученных КП ОКТ изображениях трех отделов уретры (проксимальном, среднем и дистальном) и шейки мочевого пузыря измерена толщина эпителиального и соединительнотканного слоев.
Измерения проведены с использованием стандартных функций в программе ImageJ ручным способом двумя независимыми респондентами. Статистический анализ данных по изменению толщины слоев тканей уретры в связи с длительностью заболевания (до 1 года и более 1 года) и в зависимости от возраста пациенток выполняли по стандартной методике с использованием пакета «Statistica 12». Во всех трех категориях групп больных выявлен уникальный характер группового эффекта возрастных изменений толщины тканей уретры (ВИТТУ). Графическая аппроксимация линейного группового тренда ВИТТУ для всех трех групп пациенток выполнена в приложении MS Excel. Анализ групповой линейной динамики ВИТТУ выполнен в трех сегментах уретры, а также шейке мочевого пузыря для эпителия и соединительной ткани. Процентные показатели группового изменения амплитуды скоростей (АИС) ВИТТУ в абсолютном выражении производились по формуле: % изм. = | АИС ВИТТУ после 1 года – АИС ВИТТУ до 1 года/АИС ВИТТУ до 1 года| • 100%
РЕЗУЛЬТАТЫ
При физикальном исследовании у пациенток с УБС в 56,5% (n=13) случаев уретра определялась, как плотная, ригидная, иногда болезненная структура; у остальных уретра была безболезненной, плотно-эластичной. В 39,1% (n=9) случаях выявляли болезненность в области передне – боковых стенок влагалища. Проба О´ДоннелаХиршхорна (вагинизация уретры с ее зиянием) была положительной в 6 (26%) случаях. При цистоскопическом исследовании у всех пациенток слизистая оболочка МП была блестящей, бледнорозовой, лишь в 28,6% (n=8) случаях визуально имелась незначительная гиперемия в зоне мочепузырного треугольника и в шейке мочевого пузыря. Оценить состояние уретры при стандартном цистоскопическом исследовании было невозможно.
КП ОКТ исследование:
Уретра, как и стенка мочевого пузыря, в норме или в случае доброкачественных процессов на КП ОКТ изображении в ко-поляризации (нижняя часть изображения) имеет 3 «слоя» (рис. 1 б-г). Верхний – однородный слой со средней интенсивностью сигнала – соответствует уротелию. Второй слой с высокой интенсивностью сигнала включает субэпителиальные соединительнотканные структуры: собственную пластинку слизистой оболочки и подслизистую оболочку. Граница уротелий – подлежащая соединительная ткань при этом четкая. Третий, нижний слой с низким уровнем сигнала соответствует мышечной оболочке. В кросс-поляризации (верхняя часть изображения) весь ОКТ-сигнал соответствует субэпителиальным соединительнотканным структурам, поскольку уротелий и мышечная оболочка практически не обладают рассеянием в этот канал.
Методом КП ОКТ при УБС выявлены атрофия эпителиального слоя в 69,5% (n=16) и фиброз подэпителиальных структур с их утолщением – в 82,6% (n=19) случаев. У женщин репродуктивного возраста (до 49 лет) по результатам КП ОКТ исследования обнаружен факт различий в состоянии проксимальной 1/3 уретры и ее дистальных 2/3. В проксимальной части по КП ОКТ, как правило, выявлялись такие же изменения, как в шейке мочевого пузыря, вплоть до гиперплазии эпителия, при этом в дистальных 2/3 уретры чаще наблюдалась атрофия эпителия. У 5 пациенток в средней и дистальной частях уретры по КП ОКТ изображениям удалось зафиксировать выводные протоки желез (рис. 1, 3г, желтые стрелки), в 9 случаях – расширенные кровеносные сосуды. Динамика групповых изменений количественных характеристик ВИТТУ свидетельствует о том, что большая часть этой составляющей для группы УБС соответствует промежуточному положению относительно нормы и группы воспаления, чем таковой для нормы. При этом эпителий тоньше нормы, а соединительнотканная строма значительно утолщена (рис. 1, ряд 3).
Анализ тенденции группового ВИТТУ при УБС
Для шейки мочевого пузыря при УБС с длительностью болезни до года выявлено, что толщина эпителия у женщин репродуктивного возраста ниже нормы, в то время, как у женщин за 50 лет, эпителий имеет тенденцию к гиперплазии (рис. 2 а). Причем определено, что в норме на фоне истончения эпителия толщина соединительнотканного матрикса шейки мочевого пузыря с возрастом имеет тенденцию к увеличению. При наличии УБС более года толщина соединительнотканного матрикса в шейке мочевого пузыря тоньше нормы (рис. 2 б). Состояние проксимальной части уретры: при длительности заболевания УБС до года толщина эпителия меняется незначительно, изменения сопоставимы с нормой (рис. 2 в), а скорость изменяется значительномедленнее, чем при воспалительных процессах (таблица 1).
Толщина соединительнотканных структур при УБС больше, чем в норме и при воспалении (рис. 2 г), а скорость изменения толщины слоев в зависимости от возраста пациенток сопоставима со скоростью групповых изменений тканей в норме (табл. 1). При длительности заболевания УБС более года наблюдали выраженное расширение зоны подэпителиальных соединительнотканных структур (рис. 2 г). Состояние среднего и дистального сегментов уретры. Выявлено, что скорость истончения эпителия уретры при УБС для болеющих до года сопоставима со скоростью его изменений при воспалительных процессах. После года болезни у пациенток старших возрастных групп истончение/ атрофия эпителия при УБС продолжается (рис. 2 д, ж).
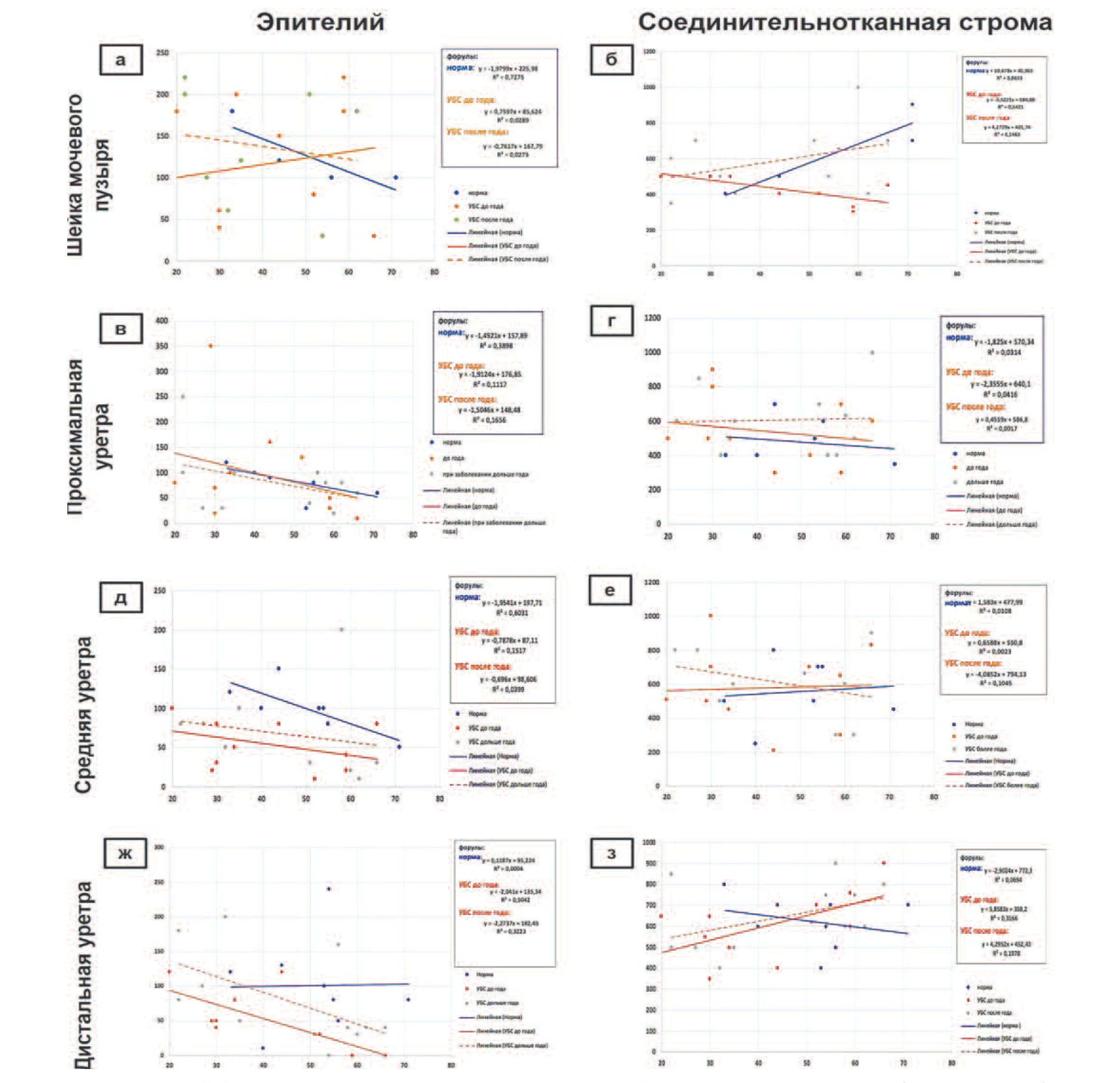
Рис. 2. Графики линейной тенденции группового ВИТТУ для эпителия и соединительнотканной стромы уретры в группах пациенток с УБС при длительности заболевания до года и более года в сравнении с группой нормы
Fig. 2. Graphs of the linear trend of ARCTUN group for epithelium and connective tissue stroma of the urethra in groups of patients with UPS with a disease duration of up to a 1 year or more than a 1 year in comparison with the group of norm
У женщин репродуктивного возраста в средней трети уретры при УБС наблюдается значительное утолщение соединительнотканных структур по сравнению с нормой при любой длительности заболевания (рис. 2 е). При этом в группах данных ВИТТУ при длительности заболевания более года обнаружен эффект порогового антагонизма, выражающегося в пересечении линейной результативной обще групповой тенденции изменения толщины соединительнотканных структур (рис. 2 д, е, пунктирная линия оранжевого цвета) с таковой в группе нормы (линия синего цвета) на границе возрастного участка примерно в 50-55 лет. Это свидетельствует о том, что амплитуда скорости изменения толщины ткани меняется со знака "+" на "-" и, соответственно, направление прямой линии регрессии в групповом эффекте ВИТТУ меняется с возрастания на убывание, что, вероятно, связано с изменениями в гормональном статусе женщины. Выявлено, что динамика групповых изменений соединительнотканных структур дистальной части уретры при УБС отличается от ее средней части.
Так у женщин репродуктивного возраста при любой длительности заболевания для соединительнотканных структур зафиксировано ВИТТУ меньше нормальных значений, в то время, как у женщин старше 49-50 лет явления фиброза прогрессируют и приводят к утолщению соединительнотканных структур по сравнению с нормой (рис. 2 з). Таким образом, при УБСпроцессыдинамических групповых изменений ВИТТУ похожи на таковые при хроническом воспалении – эпителий гипо- и атрофичен по сравнению с нормой, а соединительнотканная строма утолщается. Анализ скорости изменений в группах ВИТТУ: Из таблицы 1 видно, что активность групповых изменений в эпителии при хроническом воспалении инфекционного генеза значительно выше, чем при УБС. Скорость группового изменения соединительнотканных структур (утолщение) при длительности болезни более года при УБСзначительно возрастает в шейке, проксимальной и дистальной частях уретры, при этом скорость изменения тканей в этих же сегментах при хронических воспалительных процессах несколько ниже (табл. 2).
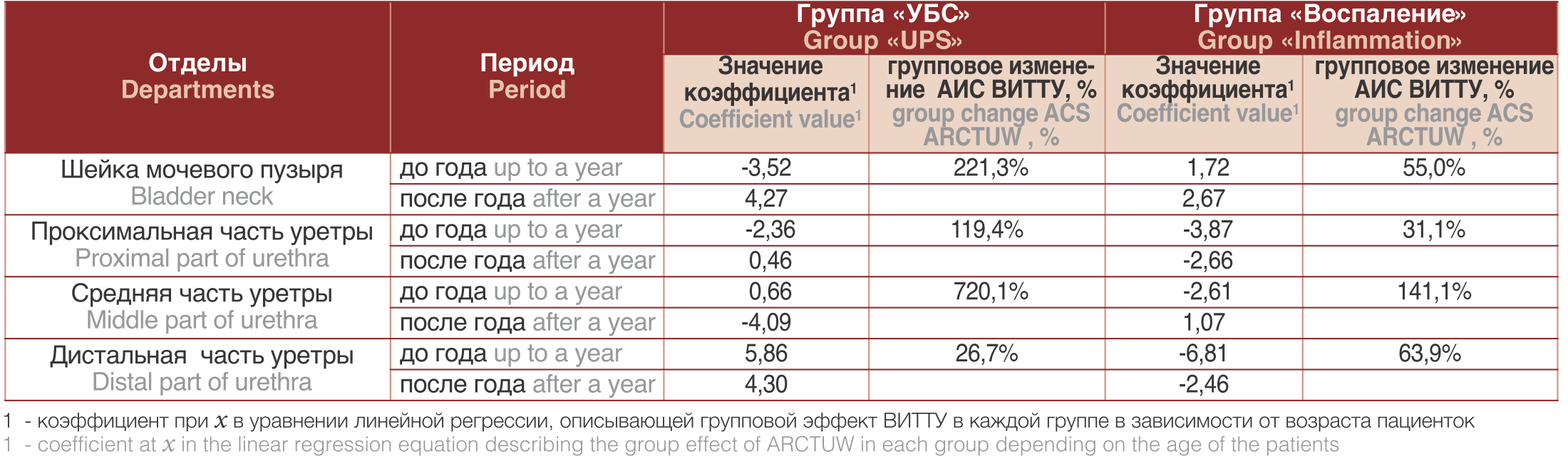
Из таблицы 2 видно, что активность групповых изменений в соединительной ткани при УБС значительно выше, чем при воспалении. Таким образом определено, что при УБС выявлены фазы течения заболевания, которые отличаются скоростью группового изменения толщин тканей уретры. ОБСУЖДЕНИЕ В большинстве случаев при УБС клинически не выявляют какой-либо патологии нижних мочевых путей при использовании стандартных инструментальных методов исследования: цистоскопии, УЗИ, компьютерной томографии, магнитно-резонансной томографии. Поэтому существует необходимость объективной оценки истинного состояния тканей, которые не вызывают визуальных изменений. Ключевым методом в алгоритме обследования структурного анализа тканей нижних мочевых путей у женщин в нашем исследовании является метод КП ОКТ, позволяющий, подобно оптической биопсии, получать информацию об общей внутренней структуре ткани и состоянии отдельных ее компонентов (эпителиальном слое, соединительнотканном матриксе, сосудистой сети, мышечном слое).
Таблица 1. Сравнительная активность группового изменения амплитуды скоростей ВИТТУ при УБС и воспалении в эпителии у больных до и после года периода заболевания
Table 1. Comparative activity of the group change in the speed amplitude of ARCTUW in patients with UPS and inflammation in the epithelium in patients before and after the year of the disease period
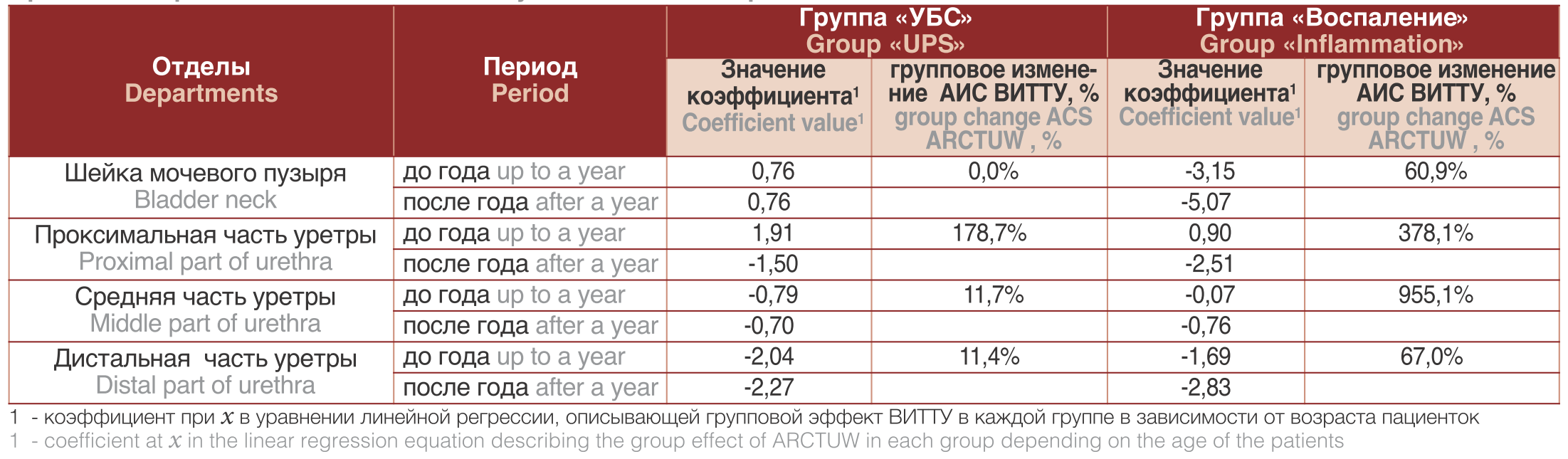
Таблица 2. Сравнительная активность группового изменения амплитуды скоростей ВИТТУ при УБС и хроническом воспалении в соединительной ткани у больных до и после года периода заболевания
Table 2. Comparative activity of a group change in the speed amplitude of ARCTUW with UPS and chronic inflammation in the connective tissue in patients before and after a year of the disease period
Особое внимание уделено исследованию соединительнотканного матрикса (коллагеновым и эластическим волокнам), который является неотъемлемой частью регуляции тканевого метаболизма и таким образом, играет основополагающую роль в физиологических процессах тканей. Метод КП ОКТ подходит для этой цели наилучшим образом, поскольку детектирует изменения в характере рассеяния и кросс-рассеяния от исследуемой ткани прижизненно (в процессе процедуры цистоскопии) позволяет диагностировать трофические нарушения ткани, фиброз, верифицировать состояния воспалительного и не воспалительного генеза. Новые технологии биофотоники (ОКТ, КП ОКТ), позволяют провести углубленный объективный анализ ткани, выявить патогенетические основы заболеваний, диагноз которых в настоящее время формулируется как «диагноз исключения».
В основе решения поставленной клинической задачи лежит анализ состояния соединительнотканного матрикса тканей нижних мочевых путей, как основной структуры, поддерживающей трехмерную архитектонику тканей, взаимосвязь клеток в межклеточном пространстве. Роль соединительнотканного матрикса в физиологических процессах тканей является основополагающей, поскольку матриксные структуры – волокнистый компонент (коллагеновые и эластические волокна) и аморфный компонент (гликопротеины, гликозаминогликаны, протеогликаны и их агенты) – биохимически ифункционально связаны. Они играют важнейшую роль в регуляции тканевогометаболизма, являясь для клеток опорными структурами и химическими раздражителями [12]. Существует гипотеза, что помимо функций соединительной ткани, эта сеть является источником механочувствительной сигнализации, а также сигналов, направленных на клеточное и тканевое ремоделирование [13].
Согласно принципу единства структуры и функции предполагается, что состояние соединительнотканного матрикса может изменяться при различных патологических состояниях: травме, боли, воспалении [14]. Известно, что морфологическое исследование при синдроме болезненного мочевого пузыря выявляет подслизистый фиброз [15]. Таким образом, корректная оценка состояния соединительнотканного матрикса может стать ключевым моментом в диагностике и мониторинге лечения заболеваний нижних мочевыводящих путей, не имеющих выраженных визуальных проявлений. Ранее возможности диагностики состояния соединительнотканного матрикса внутренних органов были существенно ограничены. Фактически единственным методом, позволяющим оценить структуру коллагена и эластина на уровне волокон было гистологическое исследование с использованием специального окрашивания. Альтернатива стандартному гистологическому исследованию появилась в течение последних двадцати лет, когда был разработан и внедрен в клиническую практику метод КП ОКТ.
Метод позволяет косвенно оценить состояние соединительнотканного матрикса на уровне общей архитектоники ткани на основании информации о ее рассеивающих и поляризационных свойствах [16].Данный метод продемонстрировал свою эффективность в урологии, стоматологии [17], гинекологии [18], ангиологии [19], а с 2015 года – в нейрохирургии [20].Являясьметодомприжизненной визуализации,КП ОКТ имеет пространственное разрешение порядка 15-20 мкм при глубине зондирования 1,5-2 мм, что позволяет характеризовать изменения нормальной структуры тканей стенки мочевого пузыря и уретры на уровне общей архитектоники (по свойствам общего обратного рассеяния зондирующего излучения), а также регистрировать изменения состояния подэпителиальных коллагенсодержащих компонентов слизистой оболочки мочевого пузыря (по свойствам кросс-рассеяния от волокнистых структур).
Этот метод может стать верифицирующим критерием при диагностике состояния нижних мочевых путей при хронической тазовой боли, в том числе при УБС, поскольку позволяет регистрировать спектральные и топологические признаки состояния соединительнотканного матрикса слизистой оболочки мочевого пузыря и уретры. Статистический анализ ВИТТУ позволил акцентировать внимание на природе исследуемого заболевания. Так, в исследовании показано, что большая часть данных ВИТТУ группы УБС для эпителия принимает более низкие значения, чем в группе нормы – его атрофия. Причем эти динамические изменения соответствует промежуточному положению относительно групп «нормы» и «воспаления», и это соответствие ближе к групповой динамике «воспаление» чем таковой для «нормы».
Эффект порогового антагонизма, выявленный у возрастных групп для соединительнотканного матрикса слизистой оболочки уретры, доказывает эффективность метода КП ОКТ в диагностике возрастных изменений тканей нижних мочевых путей. Однофакторный дисперсионный анализ скорости группового изменения ВИТТУ как зависимого параметра, где в качестве фактора использованы сегменты уретры по их относительной удаленности от мочевого пузыря, свидетельствует о статистической значимости влияния данного фактора удаленности этих сегментов (p<0,05) в группе «воспаления», в то время, как в группе УБС этот фактор практически незначим (p>0,15). В группе «нормы» не наблюдается влияния фактора удаленности этих сегментов от мочевого пузыря на скорость группового изменения ВИТТУ.
Статистический анализ изменения толщины тканей при хронических воспалительных процессах показал, что начальный этап характеризуется высокой скоростью изменения толщины ткани уретры (эпителия и соединительнотканной стромы), а при длительности заболевания более года скорость изменений – истончения эпителия и утолщения соединительнотканной стромы, заметно снижается. Таким образом, методика КП ОКТ эффективна в диагностике процессов воспаления в тканях уретры и подтверждает общую морфологическую картину процессов. Статистический анализ данных по трендам групповых ВИТТУ, это новый обобщающий взгляд на природу собственно самого заболевания УБС.
По результатам исследования можно достаточно обоснованно утверждать, что при воспалении процессы с изменением толщины тканей (ВИТТУ) первоначально наиболее интенсивно происходят в эпителии, а затем «распространяются» на соединительнотканные структуры; а при УБС процессы с изменением толщины тканей (ВИТТУ) первоначально наиболее интенсивно происходят в соединительной ткани, а затем «распространяются» на эпителий. Важно отметить, что большая часть динамики составляющей ВИТТУ для группы УБС соответствует промежуточному положению относительно нормы и группы воспаления, чем таковой для нормы. При этом эпителий тоньше нормы, а соединительнотканная строма значительно утолщена. Таким образом, метод КП ОКТ позволяет провести углубленный объективный анализ ткани, выявить патогенетические основы заболеваний, диагноз которых в настоящее время формулируется как «диагноз исключения».
Применение метода КП ОКТ может стать основой алгоритма малоинвазивной диагностики состояния нижних мочевыводящих путей у женщин, в частности, при УБС и позволит использовать персонифицированные показатели для коррекции терапии. ВЫВОДЫ Впервые проведено исследование состояния уретры прижизненным методом визуализации – КП ОКТ. Выявлены патогенетические аспекты развития УБС, заключающиеся в активном вовлечении в процесс соединительнотканного матрикса уретры, причемактивность/ скорость изменений в соединительнотканной строме при УБС выше, чем при хроническом воспалении инфекционного генеза. Выявлено, что преобладающими изменениями в ткани уретры при УБС являются атрофия эпителиального слоя и фиброз подэпителиальных структур, что приводит к функциональным нарушениям органа.
ЛИТЕРАТУРА
- Sung TC. Is Urethral Pain Syndrome Really Part of Bladder Pain Syndrome? Urogenital Tract Infection. Urogenital Tract Infection, 2017;12(1):22-27, doi: 10.14777/uti.2017.12.1.22
- Rothberg MB, Wong JB. All Dysuria Is Local A Cost-effectiveness Model for Designing Site-specific Management Algorithms. J Gen Intern Med 2004; 19:433– 443.
- Phillip H, Okewole I,Chilaka V. Enigma of urethral pain syndrome:Why are there so many ascribed etiologies and therapeutic approaches? International J Urol 2014; 21: 544–548.
- IASP Classification of Chronic Pain, Second Edition (Revised). Descriptions of Chronic Pain Syndromes and Definitions of Pain Terms.Available at: https://www.iasp-pain.org/PublicationsNews/Content.aspx?ItemNumber=1673&... – URL: 28.05.2019.
- Engeler D, Baranowski AP. Клинические рекомендация EAU по Хронической тазовой боли. Перевод: К.А. Ширанов, под ред.: А.В. Зайцева, 2017: 8-13.
- Fall M, BaranowskiAP, Elneil S, Engeler D, HughesJ, Messelink EJ. et al.Синдром хронической тазовой боли. EAU. Перевод: Ю.В. Алымов, под ред.: М.И. Когана, 2011: 101
- Kiseleva ЕB, Kirillin MYu, Feldchtein FI, Vitkin IA, Sergeeva EA, Zagaynova EV. et al. Differential diagnosis of human bladder mucosa pathologiesin vivowith cross-polarization optical coherence tomography. Biomed Opt Express 2015; 6(4):1464-1476. DOI: 10.1364/BOE.6.001464.
- Загайнова Е.В., Стрельцова О.С., Гладкова Н.Д., Фельдштейн Ф.И., Орлова А.Г. Оптическая когерентная томография в урологии. Руководство по оптической когерентной томографии / под ред. Гладковой Н.Д., Шаховой Н.М., Сергеева А.М. М.: Физматлит, Медицинская книга, 2007: 134-152. [Zagajnova E.V., Strel'cova O.S., Gladkova N.D., Fel'dshtejn F.I., OrlovaA.G. Optical coherence tomography in urology. Guide to OpticalCoherent Tomography / Ed. Gladkova N.D., Shakhova N.M., SergeevaA.M. M.: Fizmatlit, Medicinskaya kniga, 2007: 134-152. (In Russian.)].
- Freund JE, Buijs M, Savci-Heijink CD, de Bruin DM, de la Rosette JJMCH., van Leeuwen TG. et al. OpticalCoherence Tomography in Urologic Oncology: aComprehensive Review. SN Comprehensive Clinical Medicine 1(2): 67-84. doi: https://doi.org/10.1007/s42399-018-0016-5.
- Tsai TH, Leggett CL, TrindadeAJ, SethiA, SwagerAF, Joshi V. et al. Optical coherence tomography in gastroenterology: a review and future outlook. J Biomed Optics 2017: 22(12): 121716. https://doi.org/10.1117/1.JBO.22.12.121716.
- Kirillin MYu, Motovilova T, Shakhova NM. Optical coherence tomography in gynecology: a narrative review. J Biomed Optics 2017: 22(12): 121709. https://doi.org/10.1117/ 1.JBO.22.12.121709.
- Шафранов В.В., Борхунова Е.Н., Таганов А.В., Короткий Н.Г. Келоидные рубцы у детей. М.: Династия, 2006: 112. [SHafranov V.V., Borhunova E.N., Taganov A.V., Korotkij N.G. Keloid scars in children. M.: Dinastiya, 2006: 112. (In Russian.)].
- Frantz C, Stewart KM, Valerie M. e extracellular matrix at a glance. Weaver Journal of Cell Science 123, 4195-4200 © 2010. doi:10.1242/jcs.023820
- Кульчавеня Е.В., Краснов В.А. Болезни мочевого пузыря. Н.: Наука, 2012: 187. [Kul'chavenya E.V., Krasnov V.A. Bladder disease. N.: Nauka, 2012: 187. (In Russian.)].
- МиркинЯ.Б.,КарапетянА.В.,ШумаковС.Ю. Интерстициальный цистит: дискуссия о патогенезе, диагностике и лечении. Часть 1-патогенез. Экспериментальная и клиническая урология 2017, 4: 96-100.[MirkinYA.B.,KarapetyanA.V., SHumakov S.YU.Interstitial cystitis: a discussion about pathogenesis, diagnosis, and treatment. Part 1 pathogenesis. Eksperimental'naya i klinicheskaya urologiya 2017, 4: 96-100. (In Russian.)].
- Геликонов В.М. Кросс-поляризационная ОКТ с активным поддержанием циркулярной поляризации зондирующей волны в системе с общим оптическим путем. Известия Вузов. Радиофизика 2017, LX(11): 966.[Gelikonov V.M.Cross-polarized OCTwith active maintenance of the circular polarization of the probe wave in a system with a common optical path. Izvestiya Vuzov. Radiofizika 2017, LX (11): 966. (In Russian.)].
- Kiseleva Е, Kirillin M, Feldchtein F, Vitkin I, Sergeeva E, Zagaynova E. et al. Differential diagnosis of human bladder mucosa pathologies in vivo with cross-polarization optical coherence tomography. Biomed Opt Express 2015; 6(4): 1464-1476. doi: 10.1364/BOE.6.001464.
- Shakhova N, Kuznetsova I, Yunusova K, Kiseleva E. Diagnosis of neoplastic processes in the uterine cervix. Chapter 70. Handbook of Biophotonics Volume 2. Photonics for Health Care. First Edition. Edited by J. Popp, V. Tuchin,A.Chiou and S.H. Heinemann. Wiley-VCH. 2012: 1041-1049.
- Gubarkova EV, Dudenkova VV, Feldchtein FI, Timofeeva LB, Kiseleva EB, Kuznetsov SS et al. Multi-modal optical imaging characterization of athero-sclerotic plaques. J Biophotonics 2016. 9(10):1009-1020.
- Kiseleva EB, Yashin KS, Moiseev AA, Timofeeva LB, Gelikonov GV, Medyanik IA. et al. Quantitative cross-polarization OCT detection of infiltrative tumor margin in rat glioma model: pilot study. Sovremennye tehnologii v medicine 2018, 10(1): 6-14. doi: 10.17691/stm2018.10.1.01.
Статья опубликована в журнале "Экспериментальная и клиническая урология" №3 2019, стр. 170-177