С.А. Серебряный, Н.Г. Кешишев, Н.В. Поляков, А.И. Сидиропуло
НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Cтриктуры везикоуретрального анастомоза (СВУА) после радикальной простатэктомии (РПЭ) являются легко операбельными осложнениями с возможностью их ликвидации малоинвазивными методами, а также расширенными операциями. У пациентов с СВУА может наблюдаться недержание мочи, но также возможно и адекватное удержание мочи при наличии данного осложнения. Частота возникновения СВУА варьирует от 9,6 до 21,8% [1-5]. Сроки возникновения СВУА по данным различных источников разнятся и варьируются от двух до 30-и месяцев после РПЭ. Методы лечения данного осложнения требуют обсуждения, так как, несмотря на наличие множественных способов лечения СВУА, как эндоскопических, так и открытых, до сих не существует единого наиболее совершенного стандарта.
Необходимо отметить, что современный подход к лечению СВУА начинается с диагностического поиска, а именно с исключения наличия стриктуры какого-либо иного отдела уретры, вне зоны везикоуретрального анастомоза (ВУА). В большинстве случаев диагностический поиск начинается с неинвазивных методов обследования, выполняется: урофлоуметрия, ретроградная уретрография, совмещенная антеретроградная цистуретрография (при наличии у пациента цистостомического дренажа, что может подразумевать облитерацию ВУА), экскреторная цистоуретрография и микционная цистоуретрография. Далее для подтверждения диагноза прибегают к малоинвазивным методам, к ним относится смотровая уретроцистоскопия, что почти всегда совмещается с попыткой проведения лечебной процедуры по ликвидации стриктуры (инцизия, бужирование) [6].
Способы лечения СВУА можно разделить на две группы: эндоскопические и открытые. Медикаментозное лечение в качестве монотерапии не рационально, однако в сочетание с хирургической манипуляцией увеличивает процент эффективности и благоприятного прогноза.
На рисунке 1 представлен алгоритм, разработанный Н. Öztürk и соавт. для определения тактики лечения больных, страдающих СВУА [7].
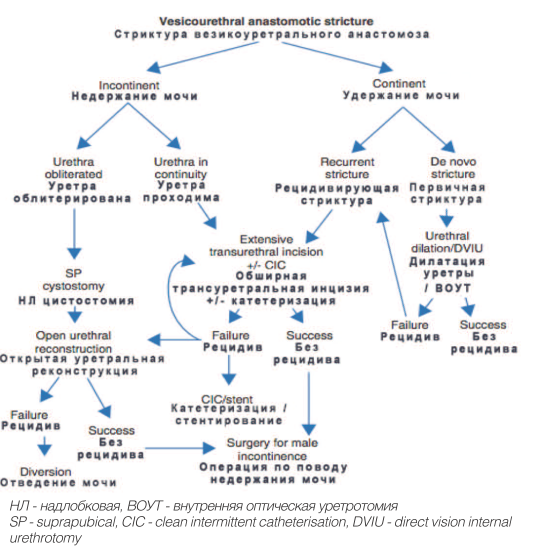
Рис. 1. Алгоритм лечебной тактики ведения больных страдающих стриктурами везикоуретрального анастомоза.
Fig.1. Algorithm of therapeutic tactics used for managing patients with stricture of vesicourethral anastomosis
В случаях, когда имеет место облитерация уретры, ввиду множества возможных осложнений эндоскопические методы не применяются с лечебной целью, но, тем не менее, для подтверждения диагноза рекомендовано проведение уретроскопии. Также, согласно исследованиям, стриктуры более 2 см в протяженности имеют больший процент рецидивирования. В таких случаях эндоскопическое лечение не показано [8].
МАТЕРИАЛЫ И МЕТОДЫ
Проведен поиск в базах Pubmed, Web of science, Сyberleninka, elibrary, ЦНМБ за период с 1994 г. по 2019 г. по следующим ключевым словам: лечение стриктур везикоуретрального анастомоза, инцизия, бужирование, эндоскопическая коррекция, лазерная аблация, плазменная вапоризация, робот-ассистированный реанастомоз, пластика уретры буккальным лоскутом.
ЭНДОСКОПИЧЕСКИЕ МЕТОДЫ ЛЕЧЕНИЯ СВУА
Эндоскопические методы используются как первый этап лечения ввиду низкой травматичности, легкости выполнения и информативности. Для безрецидивного течения значительному проценту пациентов (в среднем 64%) требуется одна эндоскопическая манипуляция по купированию СВУА [9-11]. Современные эндоскопические методы лечения СВУА включают в себя трансуретральную резекцию (ТУР), лазерную и плазменную аблацию, бужирование (по данным некоторых авторов: в сочетание с медикаментозным лечением) и инцизию холодным ножом.
Суть эндоскопических методик лечения заключается в удалении фиброзной ткани с целью обеспечения адекватного пассажа мочи через ВУА и также в дилатации рубцовой ткани. Инцизия холодным ножом, баллонная дилатация и бужирование являются наиболее используемыми процедурами благодаря простоте техники выполнения. Однако в большинстве случаев они оказываются недостаточными для достижения безрецидивного течения.
По данным различных авторов, дилатация рубцовой ткани проводится с помощью бужей (filiform & followers, набором амплаца и клаттона, Cook's S-curve) либо баллонным дилататором (нефростомический баллон Ultraxx, баллонный дилататор Nottingham). При бужировании, как и при дилатации, место стриктуры расширяется до 30F, по данным некоторых авторов до 24F -18F. После каждой выполненной манипуляции обязательным является катетеризация мочевого пузыря. Существуют различные методы послеоперационного ведения больных, но самым распространенным является обучение пациентов самокатетеризации мочевого пузыря для поддержания калибра расширенной уретры в области стриктуры. По данным R. Park и соавт. пациенты проводили самокатетеризацию 1 раз в день в первый месяц после дилатации, 2 раза в неделю – во второй месяц и 3 раза в неделю – в третий. Р. Ramchandani и соавт. рекомендовали самокатетеризацию 1 раз в день в течение 4-6 недель, а затем 2 раза в неделю в течение 4-6 недель. Эффективность первичной дилатации колеблется от 38 до 81%, повторной – до 100% [12-15].
Для ликвидации СВУА также используются методики с применением электричества, излучения (лазерная аблация) и плазменной вапоризации. Техника эндоскопических методов разнится, однако способ выполнения практически одинаков, различаются места иссечения ткани. Некоторые авторы избегают вмешательства в промежутке между 5-ти и 7-ми часами условного циферблата (УЦ), так как высок риск повреждения прямой кишки. В зависимости от места инцизии колеблется и эффективность манипуляции. Например при инцизии (лазерной, электроили холодным ножом) на 3-х и 9-и часах УЦ эффективность достигает 46% после первой маниуляции и 72% – после второй. При инцизии холодным ножом на 4х, 8-и и 12-и часах УЦ эффективность первой манипуляции составила 74% после первой операции [16,17]. Также известен метод циркулярной электрорезекции рубцовой ткани, эффективность которой может достигать 46% после первой операции и 100% – после второй. Н. Öztürk применил циркулярную плазменную аблацию СВУА, с 82% эффективностью после первой манипуляции.
Также набирают популярность сочетанные методы лечения, заключающиеся в том, что одномоментно проводятся две манипуляции, например: инцизия и дилатация, инцизия и вапоризация стриктуры [18] и лазерная инцизия с лазерной вапоризацией [19].
Сочетание вышеописанных методов с введением лекарственных веществ в зону СВУА показало хорошие результаты касательно отсутствия рецидивов. В частности ряд авторов используется следующие комбинации, показавшие хорошие результаты:
- бужирование до 26Ch с трансректальным введением пролонгированных стероидов под УЗИ контролем в зону СВУА показало до 80% процентов безрецидивного течения после первой операции. Среднее время наблюдения составило 62,5 месяца [20];
- бужирование до 26Ch с предварительным введением 0,1мг митомицина С, разведенного в 2 мл солевого раствора, на 3-х, 6-и и 9-и часах УЦ стриктуры ВУА, показало до 79% безрецидивного течения после первой операции. Длительность наблюдения составило 12 месяцев;
- лазерная аблация СВУА на 3-х и 9-и часах с последующим введением в зону инцизии триамцинолона показала до 70% безрецидивного течения после первой операции. Пациенты наблюдались в течение 24 месяцев [21];
- инцизия холодным ножом (в двух модификациях) с последующим введением митомицина С в места инцизии показала до 76% безрецидивного течения после первой операции. Срок наблюдения – 4 месяца [11].
ОТКРЫТЫЕ ОПЕРАЦИИ ПРИ СВУА
В случаях, когда эндоскопические методы лечения оказываются неэффективны, прибегают к открытым вмешательствам. В частности, выполняют операцию по наложению везикоуретрального реанастомоза промежностным, позадилонным или смешанным доступом. Реанастомоз накладывается шестью узловыми швами PDS 4/0. Преимущество промежностного доступа заключается в отсутствии предыдущих вмешательств и, соответственно, в отсутствии послеоперационных рубцов на коже. Недостатком таких операций является вынужденное воздействие на наружный сфинктер уретры и, как следствие, больший процент появления послеоперационного недержания мочи и необходимость повторного оперативного вмешательства для имплантации искусственного сфинктера мочевого пузыря. Преимущество позадилонного доступа заключается в том, что из-за расположения стриктуры проксимальнее наружного сфинктера уретры, последний остается интактным при операции, что положительно сказывается на удержании пациентом мочи в послеоперационном периоде. Недостаток такого доступа – это вынужденная грубая мобилизация мочевого пузыря из спаечного процесса после предыдущей простатэктомии. Также, в некоторых случаях было необходимо выполнить пубэктомию, как при промежностном доступе, так и при позадилонном.
К категории открытых реконстуктивных операций по поводу СВУА относится и экстраперитонеоскопическая робот-ассистированная реконструкция, которая может служить заменой простой реконструкции при наличии системы DaVinci. Показанием к такому виду операции также является неуспешная попытка эндоскопической коррекции. Ход операции схож с таковым при радикальной простатэктомии экстраперитонеоскопическим доступом, однако без применения 4-го манипулятора. После мобилизации шейки мочевого пузыря производится вскрытие передней стенки мочевого пузыря, что приводит к экспозиции фиброзной ткани на месте везикоуретрального анастомоза. Далее производится иссечение фиброзной ткани до визуализации шейки с хорошо васкуляризированными краями. Резекция продолжается в сторону наружного сфинктера мочевого пузыря до появления ткани с отсутствием фиброза. Ушивание дефекта стенки мочевого пузыря проводится нитью V-loc 3-0. В случае расширенного дефекта передней стенки мочевого пузыря используется васкуляризированный клапан из ткани мочевого пузыря. Первоначальная мобилизация мочевого пузыря и использование клапана препятствует безнатяжному соединению шейки мочевого пузыря и уретры. Остатки фасции Денонвилье и детрузор фиксируются к задней части рабдосфинктера для минимизации натяжения. Далее производится везикоуретральный анастомоз двумя нитьями V-loc 3-0, начиная с задней поверхности мочевого пузыря. Перед переходом на переднюю поверхность в мочевой пузырь устанавливается катетер 20Ch. Проверка герметичности после ушивания производится наполнением мочевого пузыря до 60мл NaCl 0,9%. Такая методика показала удовлетворительные результаты у 75% пациентов [22].
W. Shahrour и соавт. проводят пластику уретры буккальным лоскутом как реконструктивную операцию по поводу СВУА. Промежностным доступом осуществляют доступ к бульбозному отделу уретры. Уретра вскрывается до шейки мочевого пузыря и лоскут имплантируется на участок от 11-ти до 13-ти часов УЦ и ушивается нитью Викрил 4-0. Согласно данному исследованию у 100% пациентов не наблюдалось рецидивирования заболевания в течение 3 месяцев [23].
Также с развитием применения радиоактивных веществ в лечении различных заболеваний D. Kröpfl и соавт. проводили брахитерапию как рецидивирующих, так и первичных СВУА с использованием зерен 192Ir. Под наблюдением находились 15 пациентов в среднем 24 месяца. Процент безрецидивной эффективности после облучения составил 46% [24].
ЗАКЛЮЧЕНИЕ
Исходя из анализа данных литературы, можно сделать вывод, что при большом многообразии методов устранения СВУА после радикальной простатэктомии, невозможно выделить один, наиболее эффективный и безопасный способ лечения, однако множество ранее используемых методик в настоящее время не применяются благодаря появлению новых, более технологичных методов. Конечно же, открытые методы лечения уступают эндоскопическим в плане простоты выполнения, травматичности, а в некоторых случаях и эффективности. Однако при персистирующей СВУА на помощь приходят открытые вмешательства по устранению данной проблемы у пациентов.
ЛИТЕРАТУРА
- Ананий И.А., Невирович Е.С., Амдий Р.Э. Наш опыт диагностики и лечения расстройств мочеиспускания у больных после радикальной простатэктомии. Медицинский вестник Башкортостана 2015; 10(3): 121-124 [Ananiy I.A., Nevirovich E.S., Admiy R.E. Our experience of diagnosis and treatment of voiding complications after radical prostatectomy. Meditsinskiy vestnik Bashkortostana = Medical Bulletin of Bashkortostan 2015; 10(3): 121-124 (In Russian)].
- LaBossiere JR, Cheung D, Rourke K. Endoscopic treatment of vesicourethral stenosis after radical prostatectomy: outcomes and predictors of success. J Urol 2016;195(5): 1495–1500. doi: 10.1016/j.juro.2015.12.073.
- Giúdice CR, Lodi PE, Olivares AM, Tobia IP, Favre GA. Safety and effectiveness valuation of open reanastomosis for obliterative or recalcitrant anastomotic stricture after radical retropubic prostatectomy. Int Braz j Urol 2019; 45(2): 253–261. doi:10.1590/s1677-5538.ibju.2017.0681.
- Lavollé A, de la Taille A, Chahwan C, Champy CM, Grinholtz D, Hoznek A, et al. Extraperitoneal robot-assisted vesicourethral reconstruction to manage anastomotic stricture following radical prostatectomy. Urology 2019; pii: S0090-4295(19)30698-3. doi:10.1016/j.urology.2019.07.027.
- Sourial MW, Richard PO, Bettez M, Jundi M,Tu LM. Mitomycin-C and urethral dilatation: a safe, effective, and minimally invasive procedure for recurrent vesicourethral anastomotic stenoses. Urol Oncol 2017;35(12): 672.e15-672.e19. doi:10.1016/j.urolonc.2017.07.031.
- Browne BM, Vanni AJ. Management of Urethral Stricture and Bladder Neck Contracture following primary and salvage treatment of prostate cancer. Curr Urol Rep 2017;18(10): 76 doi:10.1007/s11934-017-0729-0.
- Öztürk H. Treatment of recurrent vesicourethral anastomotic stricture after radical prostatectomy using plasma-button vaporization. Scand J Urol 2015;49(5): 371–376. doi: 10.3109/21681805.2015.1012115.
- Wessells H, Angermeier KW, Elliott S, Gonzalez CM, Kodama R, Peterson AC, et al. Male urethral stricture: American urological association guideline. J Urol 2017;197(1): 182-190. doi: 10.1016/j.juro.2016.07.087.
- Ramirez D, Zhao LC, Bagrodia A, Scott JF, Hudak SJ, Morey AF. Deep lateral transurethral incisions for recurrent bladder neck contracture: promising 5-year experience using a standardized approach. Urology 2013;82(6): 1430-1435. doi: 10.1016/j.urology.2013.08.018.
- Brede C, Angermeier K, Wood H. Continence outcomes after treatment of recalcitrant postprostatectomy bladder neck contracture and review of the literature. Urology 2014; 83(3): 648-652. doi: 10.1016/ j.urology.2013.10.042.
- Nagpal K, Zinman LN, Lebeis C, Alex J. Vanni, Jill C. Buckley. Durable results of mitomycin C injection with internal urethrotomy for refractory bladder neck contractures: multi-institutional experience. Urol Practice 2015;2(5): 250–255. doi: 10.1016/j.urpr.2014.12.007.
- Park R, Martin S, Goldberg JD, Lepor H. Anastomotic strictures following radical prostatectomy: insights into incidence, effectiveness of intervention, effect on continence, and factors predisposing to occurrence. Urology 200;57(4): 742–746. doi:10.1016/s0090-4295(00)01048-7.
- Geary ES, Dendinger TE, Freiha FS, Stamey TA. Incontinence and vesical neck strictures following radical retropubic prostatectomy. Urology 1995;45(6):1000–1006. doi: 10.1016/s0090-4295(99)80121-6.
- Zhang CY, Zhu Y, Li K, Ian L, Ho S, Pun W, et al. Outcome of nephrostomy balloon dilation for vesicourethral anastomotic strictures following radical prostatectomy: a retrospective study. Asian J Androl 2014;16(1): 115–119. doi: 10.4103/1008-682X.122348.
- Ramchandani P, Banner MP, Berlin JW, Dannenbaum MS, Wein AJ. Vesicourethral anastomotic strictures after radical prostatectomy: efficacy of transurethral balloon dilation. Radiology 1994;193(2): 345–349. doi: 10.1148/radiology.193.2.7972741.
- Giannarini G, Manassero F, Mogorovich A, Valent F, De Maria M, Pistolesi D et al. Cold-knife incision of anastomotic strictures after radical retropubic prostatectomy with bladder neck preservation: efficacy and impact on urinary continence status. Eur Urol 2008;54(3): 647–656. doi: 10.1016/j.eururo.2007.12.013.
- Popken G, Sommerkamp H, Schultze-Seemann W, Wetterauer U, Katzenwadel A. Anastomotic stricture after radical prostatectomy. Incidence, findings and treatment. Eur Urol 1998;33(4): 382–386. doi: 10.1159/000019620.
- Lagerveld BW, Laguna MP, Debruyne FM, De La Rosette JJ. Holmium: YAG laser for treatment of strictures of vesicourethral anastomosis after radical prostatectomy. J Endourol 2005;19(4): 497–501. doi: 10.1089/ end.2005.19.497.
- Серебряный С.А., Кешишев Н.Г., Поляков Н.В., Сидиропуло А.И., Каприн А.Д. Способ эндоскопического лечения стриктуры везикоуретрального анастомоза после радикальной простатэктомии. Патент на изобретение RU2694217C2. URL: http://www1.fips.ru/iiss/document.xhtml?faces-redirect=true&id=e2c916ef7.... [Serebryaniy S.A., Keshishev N.G., Polyakov N.V., Sidiropulo A.I., Kaprin A.D. Endoscopic treatment of vesicourethral anastomosis after radical prostatectomy. Patent for invention RU2694217C2. URL: http://www1.fips.ru/iiss/document.xhtml?faces-redirect=true&id= e2c916ef72d22075032dbd10eee98f16. (In Russian)].
- Kravchick S, Lobik L, Peled R, Cytron S. Transrectal ultrasonographyguided injection of long-acting steroids in the treatment of recurrent/ resistant anastomotic stenosis after radical prostatectomy. Endourol 2013;27(7): 875–879. doi: 10.1089/end.2012.0661.
- Eltahawy E, Gur U, Virasoro R, Schlossberg SM, Jordan GH. Management of recurrent anastomotic stenosis following radical prostatectomy using holmium laser and steroid injection. BJU Int 2008;102(7):796–798. doi: 10.1111/j.1464-410X.2008.07919.x.
- Kirshenbaum EJ, Zhao LC, Myers JB, Elliott SP, Vanni AJ, Baradaran N, et al. Patency and incontinence rates after robotic bladder neck reconstruction for vesicourethral anastomotic stenosis and recalcitrant bladder neck contractures: the trauma and urologic reconstructive network of surgeons experience. Urology 2018;118:227-233. doi: 10.1016/ j.urology.2018.05.007.
- Shahrour W, Hodhod A, Kotb A, Prowse O, Elmansy H. Dorsal buccal mucosal graft urethroplasty for vesico-urethral anastomotic stricture post radical prostatectomy. Urology 2019;130:210. doi:10.1016/ j.urology.2019.04.022.
- Kröpfl D, Olschewski T, Seegenschmiedt MH. Endourethral brachytherapy for the prevention of recurrent strictures following internal urethrotomy. Urologe A 2004; 43(10): 1254–1261. doi: 10.1007/s00120-004-0630-6.
Статья опубликована в журнале "Экспериментальная и клиническая урология" №4 2019, стр. 100-104