Торшин И.Ю., Аполихина И.А., Громов А.Н., Громова О.А.
Сведения об авторах:
- Торшин И.Ю. – к.ф-м.н., к.х.н., с.н.с. Институт Фармакоинформатики, ФИЦ «Информатика и Управление» РАН, Scopus Author ID 7003300274
- Аполихина И.А. – заведующая отделением эстетической гинекологии и реабилитации, профессор кафедры акушерства, гинекологии, неонатологии, анестезиологии и реаниматологии ФГБУ «НЦ АГ и П им. В.И. Кулакова», Минздрава России, AuthorID 261593
- Громов А.Н. – в.н.с. ФИЦ ИУ РАН, AuthorID 15082
DOI: 10.29188/2222-8543-2020-12-2-164-170
ВВЕДЕНИЕ
D -Манноза – эндогенный моносахарид, участвующий в N-гликозилировании более 12 000 белков протеома. N-гликозилирование является пост-трансляционной модификацией белков, которая изменяет стабильность и активность белковых структур в соответствии с потребностями клеток. В частности, N-гликозилирование принципиально необходимо для осуществления функций иммуно-глобулинов (A, D, G, E, M) и других иммунорецепторов [1].
Название молекулы «D-манноза» происходит от древнееврейского слова «манна» ( ). Как известно, манна – та самая спасительная пища, данная израильтянам, ведомым пророком Моисеем, для облегчения их перехода через Синай в Землю Обетованную. В самом деле, D-манноза калорийна, сладковата на вкус, была идентифицирована в ясене манновом (лат. Fraxinus ornus). Выделяясь из листьев Fraxinus ornus, сок растения быстро засыхает, формируя белую мелкую крупку, которую на Ближнем Востоке называют «манной» и до сего времени [2].
D-манноза усваивается микробиотой организма и частично подвергается расщеплению в процессе гликолиза. Многие представители микробиоты человека (лактобациллы, бифидобактерии, непатогенные штаммы E.coli и др.) имеют гены, кодирующие белок XYZ-пермеазы Dманнозы, необходимой для всасывания D-маннозы внутрь бактерий для последующей переработки [3]. D-манноза является метабиотиком (пребиотиком), потенциально поддерживающим рост бифидобактерий лонгум [4].
Фракция D-маннозы, всосавшаяся в кишечнике, фосфорилируется ферментом гексокиназой с образованием D-маннозо-6-фосфата в клетках печени. D-маннозо6-фосфат, при участии фермента D-манноза-6-фосфатизомеразы (ген MPI, белок P34949 по UniProtKB), превращается в D-фруктозо-6-фосфат, расщепляющийся в процессе гликолиза. Синтез D-маннозо-6-фосфата необходим для выполнения основной биологической функции D-маннозы – N-гликозилирования белков протеома [5].
В целом, экзогенная D-манноза, поступающая из пищи, частично метаболизируется микробиотой и организмом, а непереработанная фракция экзогенной D-маннозы выводится с мочой. Последний факт весьма важен для терапии и профилактики бактериального цистита: ведь моча, насыщенная D-маннозой, таргетно снижает адгезию уропатогенных бактерий (штаммы E.coli, Klebsiella, Proteus и др.) к уротелию почечных лоханок, мочеточников, мочевого пузыря и уретры [6]. При этом, терапия D-маннозой эффективно снижает симптоматику цистита и не проявляет никаких побочных эффектов, присущих антибиотикотерапии. Поэтому D-маннозу следует использовать для лечения цистита у пациентов с аллергией на антибиотики, сахарным диабетом, гипертонией, а также у беременных с преэклампсией [7].
МАТЕРИАЛЫ И МЕТОДЫ
В настоящей работе представлены результаты вычислительного анализа 33 064 публикаций по D-маннозе, найденных в базе данных биомедицинских публикаций PUBMED по запросу «D-mannose OR mannose». Анализ данного массива публикаций выполнен с использованием современных методов анализа больших данных, развиваемых в рамках топологического и метрического подходов к задачам распознавания/классификации [8-11]. В статье представлен анализ 49 научных статей, отвечающих тематике настоящего исследования.
Результаты вычислительного анализа публикаций по D-маннозе
В ходе систематического анализа литературы были определены наиболее информативные ключевые слова, отличающие публикации по специфическим эффектам D-маннозы от публикаций в контроле [12,13]. В качестве контрольной выборки публикаций использовались 33 000 случайно выбранных статей из 556 152 найденных по запросу «glucose NOT D-mannose» в базе данных PUBMED. В результате проведенного анализа текстов были отобраны более 40 информативных ключевых слов, описывающих клинико-фармакологическую специфику D-маннозы (рис. 1).
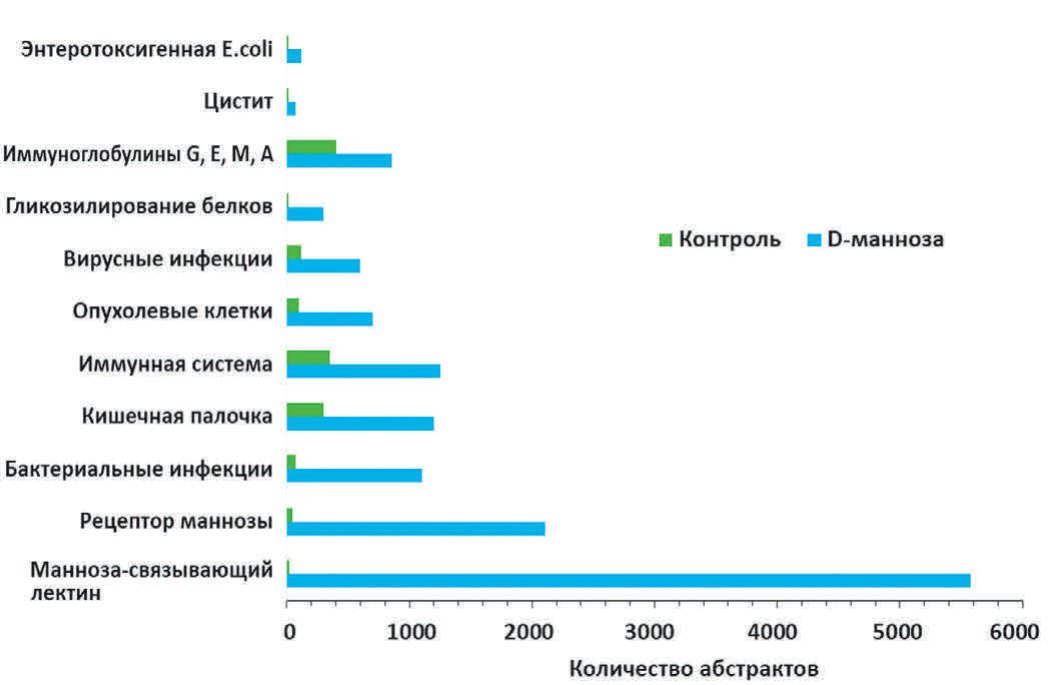
Рис.1. Количество абстрактов по ключевым словам в публикациях по D-маннозе и в контроле
Fig. 1. The number of abstracts by keywords in publications on D-mannose and in the control
РЕЗУЛЬТАТЫ
Общие сведения о D-маннозе D-манноза имеет важное значение для осуществления N-гликозилирования белков протеома (в т.ч. белков иммунной системы: комплемента, иммуноглобулинов A, G, E, M и др.). Нарушения процессов N-гликозилирования белков стимулируют дисморфогенез нервной системы, нервнопсихическую отсталость, нарушения регуляции артериального давления, свертываемости крови и иммунодефицит. D-манноза-связывающий лектин и D-маннозный рецептор принципиально важны для поддержки сердечно-сосудистой, иммунной и других систем организма. В частности, концентрации D-манноза-зависимых белков в крови ассоциированы с показателями артериального давления [14].
Первым шагом N-гликозилирования белков протеома является перенос олигосахаридного блока «Glc3Man9GlcNAc2», содержащего 9 остатков D-маннозы, на специфические остатки аспарагина в аминокислотных последовательностях белков, транспортируемых в эндоплазматический ретикулум (рис. 2). Олигосахаридный блок переносится посредством ферментного комплекса олигосахаридтрансферазы (OST). Затем происходит т.н. «вызревание» гликопротеинов в компартменте Гольджи, заключающееся в удалении избыточных остатков глюкозы и D-маннозы и добавлении необходимых остатков N-ацетилглюкозамина, галактозы и сиаловой кислоты.
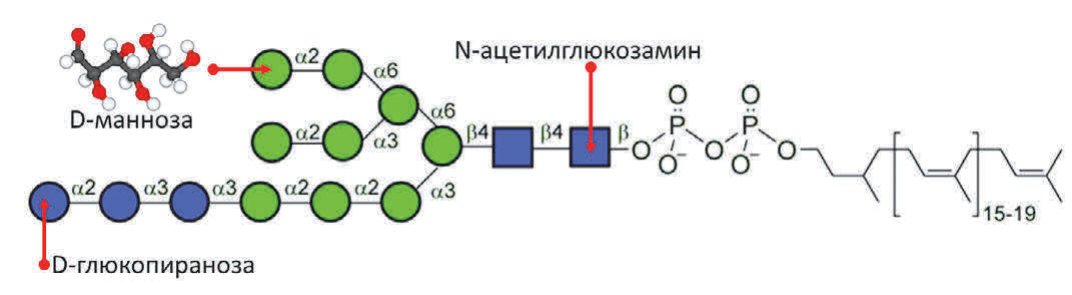
Рис. 2.Перенос олигосахаридного блока «Glc3Man9GlcNAc2» – основная реакция N-гликозилирования белков
Fig. 2. Glc3Man9GlcNAc2 oligosaccharide block transfer is the main N-glycosylation reaction of proteins
Как правило, зрелые гликопротеины человека содержат только три остатка D-маннозы, которые «защищены» остатками N-ацетилглюкозамина, галактозы и сиаловой кислоты (рис. 2). Процесс «защиты» остатков D-маннозы чрезвычайно важен для профилактики аутоиммунной патологии и поддержания антибактериального иммунитета. Действительно, «открытые», «незащищенные» остатки D-маннозы часто встречаются на поверхности гликобелков носителей бактериальных и грибковых инфекций. Поэтому, «открытые» остатки D-маннозы распознаются рецептором D-маннозы и распознаются системой врожденного иммунитета как бактериальные липополисахариды [15].
Нами найдено значительное число публикаций (2242 ссылок) по потенциальным противовирусным эффектам D-маннозы (информативные ключевые слова: вирус вакцинии, вирус парагриппа человека, коронавирус, симплекс-вирус, комплемент герпесвирус, папилломавирус, ретровирус, цитомегаловирус). Например, уровни манноза-связывающего лектина ассоциированы с прогрессированием респираторно-синцитиальной инфекции и вируса гепатита В, а уровни рецептора D-маннозы – с развитием хронической печеночной недостаточности вследствие гепатита В [16-18]. Макрофаги человека, дифференцирующиеся при достаточных уровнях витамина D3, ограничивают рост вируса лихорадки денге за счет регуляции рецептора D-маннозы [19]. Лектин водорослей с высоким содержанием D-маннозы эффективно тормозит рост вирус гриппа, а D-маннозный лектин цыплят проявляет противовирусную активность по отношению к вирусу бронхита и др [20,21]. Детальное рассмотрение противовирусных эффектов D-маннозы является темой отдельной статьи. Далее будут рассмотрены участие D-маннозы в поддержании иммунитета и в сдерживании хронического воспаления и перспективы использования D-маннозы для профилактики опухолевых заболеваний.
Участие D-маннозы в поддержании иммунитета и в снижении хронического воспаления
В экспериментах было показано, что D-манноза может ингибировать развитие аутоиммунных заболеваний и снижать уровень хронического воспаления [22]. Систематический анализ показал, что уровни D-маннозы в крови, в моче, в слизи и в других средах организма существенно влияют на прикрепление бактерий к слизистой оболочке тканей. Предотвращая адсорбцию патогенных штаммов кишечной палочки и других бактерий (шигеллы, P. aeruginosa, лейшмании, микобактерии), D-манноза способствует профилактике бактериальных заболеваний и, в т.ч., острого и хронического цистита. В поддержании антибактериального иммунитета особую роль играют упоминаемые ранее белки рецептор D-маннозы (ген CD206) и манноза-связывающий лектин (ген MBL).
Рецептор D-маннозы представляет собой С-лектин, который, в основном, присутствует на поверхности макрофагов, фибробластов и кератиноцитов [23]. Рецептор CD206 распознает «открытые» остатки D-маннозы, N-ацетилглюкозамина и фукозы на гликанах поверхности патогенных микроорганизмов. Тем самым, рецептор D-маннозы опосредует уничтожение Candida albicans и поддерживает врожденный и приобретенный иммунитет [24,25].
D-манноза-связывающий лектин (MBL) играет ключевую роль в активации комплемента – врожденного пути антибактериального иммунитета. Дефицит активности MBL ассоциирован с обострением инфекционных заболеваний. В частности, в проспективном когортном исследовании было показано, что концентрация сывороточного MBL ассоциирована с риском рецидивов заболеваний, вызванных инфекцией Clostridium difficile (n=308). Сравнение с контрольными пациентами с антибиотик-ассоциированной диареей (n=145) показало, что сниженная концентрация MBL (<50 нг/мл) соответствует повышению риска инфицирования C. difficile (ОШ 3.18, 95% ДИ 1,40-7,24, p<0,001) [26].
Избыточная активация комплемента, опосредованная D-манноза-связывающим лектином, способствует развитию и усилению тяжести протекания аутоиммунных заболеваний – рассеянного склероза (РС), синдрома Гийена-Барре (СГБ), тяжелой миастении (ТМ). В исследовании «случай-контроль» плазма была получена от здоровых контрольных лиц (n=100), а также пациентов с РС (n=120), СГБ (n=30) и ТМ (n=30). Средний уровень MBL в сыворотке крови достоверно различался между группами пациентов с РС, СГБ, ТМ и контролей (р<0,001). Установлены положительные корреляции между концентрациями MBL в сыворотке крови и тяжестью течения рассмотренных аутоиммунных патологий в соответствии с расширенной шкалой состояния инвалидности EDSS (r=+0,60 и p=<0,001), шкалой миастении QMGS (r=+ 0,56 и p=0,01) и шкалой нетрудоспособности GDS (r=+ 0,37 и p=0,04) [27].
Избыточная активация MBL различными агентами может быть предотвращена посредством D-маннозы, которая будет ингибировать MBL и, одновременно, снижать избыточную провоспалительную активность макрофагов посредством взаимодействия с рецептором D-маннозы. В частности, усиления экспрессии рецептора D-маннозы (наблюдаемое при использовании D-маннозы) снижает повреждение легочной ткани у крыс с моделью тяжелого острого панкреатита [28].
Взаимодействуя с одноименным рецептором, D-манноза стимулирует трансформацию макрофагов в т.н. «противовоспалительные макрофаги». Напомним, что макрофаги, в зависимости от клеточного фенотипа и секреции цитокинов, могут как стимулировать, так и подавлять воспаление. Трансформация фенотипа макрофагов от провоспалительного фенотипа М1 к противовоспалительному фенотипу М2 – необходимое условие лечения заболеваний, в основе которых лежит хроническое воспаление. Эта трансформация, индуцируемая при участии определенных цитокинов (в частности, ИЛ-4 и ИЛ-13), важна для регенерации тканей, поврежденных избыточным воспалением. Однако терапевтическое применение этих цитокинов in vivo не проводится вследствие высокого риска осложнений. Альтернативным подходом к изменению фенотипа макрофагов с M1 на M2 является индукция кластеризации макрофагов через D- маннозные рецепторы на поверхности клеток с использованием субстратов D-маннозы (например, в виде наночастиц, покрытых D-маннозой). В эксперименте на мышах с моделью воспалительного заболевания кишечника введение таких D-маннозных наночастиц эффективно облегчало симптомы колита без использования экзогенных цитокинов [29].
Перспективы противоопухолевых применений D-маннозы
Повышение уровней гликанов с высоким содержанием D-маннозы является общей чертой злокачественных клеток и, возможно, является одним из перспективных направлений для терапии ряда опухолей. В эксперименте D-манноза повышает естественную цитотоксичность здоровых клеток селезенки по отношению к опухолевым клеткам фибросаркомы (линия Meth-A) и карциномы предстательной железы (линия MM2) [30].
Повышенные уровни рецептора D-маннозы являются потенциальным биомаркером рака желудка. Уровень экспрессии рецептора D-маннозы в раковых клетках желудка составил 45,8%, что значительно выше, чем в окружающих тканях (20%, р=0,012). Выживаемость пациентов в подгруппе с высокой экспрессией рецепторов D-маннозы была достоверно короче, чем в подгруппе с низкой экспрессией рецепторов D-маннозы (р<0,05) [31].
Сама молекула D-маннозы является перспективным прогностическим биомаркером для пациентов с аденокарциномой пищевода. По сравнению с пациентами с низкими уровнями D-маннозы (нижняя треть концентраций D-маннозы в крови) у пациентов с более высокими уровнями D-маннозы риск рецидива заболевания снижался на 49% (ОШ 0,51; 95% ДИ 0,29-0,91; р=0,02), а риск смерти – на 56% (ОШ 0,44; 95% ДИ 0,25-0,77, р<0,01) [32].
D-манноза и ее производные избирательно накапливаются в опухолях. Например, производные D-маннозы, меченные изотопом фтора (фтор-18), могут быть использованы в качестве агентов для визуализации опухолей при проведении позитронно-эмиссионной томографии (ПЭТ). Опухолевые клетки показали значительное дозозависимое всасывание 18F-производных D-маннозы. Анализ профилей метаболитов через 10, 60 и 120 мин после инкубации с клетками гепатомы (линия AH109A) показал, что количество введенных 18F-производных D-маннозы резко уменьшалось, что указывает на его активное всасывание опухолевыми клетками. Анализ биораспределения изотопной метки 18F in vivo у крыс с перевитой внутрибрюшинной гепатомой (линия клеток AH109A) показал, что всасывание производных D-маннозы было максимально именно для опухолей [33,34].
Показано ингибирующее действие полимера D-маннозы, извлеченного из гемагглютинина Pseudomonas Aeruginosa, на инвазию и метастазирование гепатоцеллюлярной карциномы. Данный полимерный экстракт D-маннозы вызывал значительное ингибирование пролиферации клеток и остановку клеточного цикла посредством снижения уровней циклинов D1 и E, циклин-зависимых киназ CDK2 и CDK4, ядерного антигена пролиферирующих клеток (PCNA) и повышения уровней белков p21 и p27. Эти эффекты были ассоциированы с ингибированием сигнального пути пролиферации EGFR/Akt/IkB/NF-kB [35].
Избирательное накопление D-маннозы и/или ее производных в опухолевой ткани напрямую способствует противоопухолевыму действию D-маннозы. Например, 1,3,4,6-тетра-O-ацетил-2-дезокси-2- (бромацетамидо) бета-D-манноза, в концентрациях 6…9 мкМ, ингибирует включение тимидина в ДНК опухолевых клеток на 50% при лейкемии мышей (клеточная линия L1210) [36].
В эксперименте было показано, что D-манноза может увеличивать уровни регуляторных Т-клеток, тормозя рост раковых клеток [37]. D-манноза вызывает задержку роста некоторых типов опухолей in vitro, усиливая апоптоз опухолевых клеток (в т.ч. в ответ на химиотерапию). Эти эффекты были подтверждены in vivo в экспериментах на мышах после перорального приема D-маннозы. В частности, комбинация химиотерапевтических препаратов (цисплатина, доксорубицин) с D-маннозой (25 мМ) усиливает гибель опухолевых клеток посредством усиления апоптоза. Например, в экспериментах на культурах клеток остеосаркомы кости (линии Saos-2 и U2OS-e1a) D-манноза повышала эффективность цисплатины в 3,1 раза, а доксорубицина – в 2,2 раз [38].
D-манноза всасывается внутрь опухолевых клеток белком-транспортером глюкозы (GLUT) и накапливается в клетках в виде D-маннозо-6-фосфата, тем самым частично ингибируя метаболизм глюкозы и синтез гликанов. В сочетании с химиотерапией D-манноза снижает уровни антиапоптотических белков Bcl-2, что приводит к сенсибилизации опухолевых клеток к апоптозу. Восприимчивость опухолевых клеток к D-маннозе зависит от уровня фермента фосфоманноза изомеразы (PMI), т.к. низкие уровни PMI делают клетки более чувствительными к D-маннозе. Уровни фермента PMI сильно различаются у разных пациентов и разных типов опухолей, что указывает на то, что уровни PMI можно использовать в качестве биомаркера для оценки терапевтической эффективности D-маннозы [38]. Альтернативно могут разрабатываться таргетные ингибиторы PMI, которые будут способствовать повышению противоопухолевого потенциала D-маннозы.
Вопросы синергизма с инулином
Приведенные выше результаты биомедицинских исследований показывают, что D-манноза может проявлять антибактериальные, противовоспалительные и противоопухолевые свойства посредством специфических молекулярных механизмов. Эти фармакологические свойства D-маннозы усиливаются при поддержке здоровья микробиоты – совокупности бактерий-комменсалов человека, в т.ч. бифидо- и лактобактерий.
D-манноза и инулин являются синергидными метабиотиками (пребиотиками), т.е. веществами, поддерживающими рост полезной микробиоты. Ранее, был проведен хемомикробиомный анализ действия D-маннозы и D-фруктозы (структурной основы инулина) для 38 бактерий-комменсалов человека и 42 болезнетворных бактерий и грибков. Показано, что D-манноза в меньшей степени способствует росту условно-патогенных бактерий микробиома человека, чем другие метабиотики. D-манноза в большей степени, чем молекулы сравнения, может способствовать росту Bifidobacterium longum subsp. longum, продуцирующих масляную кислоту и другие короткоцепочечные жирные кислоты (КЦЖК). Положительные эффекты воздействия D-маннозы на микробиоту эффективно дополняются инулином и важны для улучшения синтеза КЦЖК, поддержки врожденного иммунитета и роста полезных штаммов E.coli [4].
В эксперименте прием Bifidobacterium longum per os тормозили развитие рака толстой кишки [39]. Bifidobacterium longum, обогащенные селеном, ингибировали рост перевитых опухолей (линии клеток гепатомы BEL7402 и H22). Кроме того, бифидобактерии усиливали эффекты противоопухолевой терапии циклофосфамидом посредством повышения уровней интерлейкина-2, стимулирования активности NK- и Т-лимфоцитов [40].
Инулин также характеризуется противоспалительными и противоопухолевыми свойствами. Было показано, что рост перевитых карцином на основе клеток цервикального рака (линия Hela) и гепатоцеллюлярной карциномы (линии клеток HepG2, 7721) тормозился инулином на 50-90% [41]. Инулин ингибировал метастазирование перевитой карциномы печени (линия клеток C3H) [42]. Фортификация мясных продуктов инулином снижала концентрацию канцерогенных нитрозосоединений, образующихся после потребления красного мяса [43]. Эффекты инулина улучшают качество жизни онкологических пациентов, повышая содержание бутирата и других КЦЖК в стуле, способствуя оздоровлению микробиты [44]. Инулин повышал эффективность терапии доксирубицином и циклофосфамидом у женщин страдающих раком молочной железы на фоне ожирения, гипертонии и хронического воспаления [45].
О клинических применениях D-маннозы для лечения цистита
У женщин в период менопаузы на фоне снижения эстрогенов развиваются урогенитальные расстройства (гиперактивный мочевой пузырь, поллакиурия, подтекание мочи, атрофический цистоуретрит и др.) [46]. Эти нарушения уродинамики создают условия для инфицирования урогенитального тракта и развития хронического бактериального цистита. При коррекции эстроген-дефицитных состояний достигается частичное улучшение урогенитальной симтоматики, но не санация урогенитального тракта [47].
Бактериальная адгезия к слизистой оболочке, опосредованная фимбриями бактерий (в частности, D-манноза-связывающими фимбриями типа 1 – ген FimH и др.), является важным условием для развития инфекций мочеполовых путей (ИМП). Если в моче присутствует повышенное количество D-маннозы, то молекулы D-маннозы, взаимодействуя c FimH и с другими адгезинами фимбрий, будут блокировать адгезию уропатогенных бактерий к мукозе уротелия. Низкие уровни D-маннозы у пациенток с ИМП делают необходимым насыщение мочи экзогенной D-маннозой для эффективной профилактики цистита [48].
В клиническом исследовании группы женщин с рецидивирующим циститом (n=308) все участницы прошли стартовую терапию острой стадии цистита ципрофлоксацином (1000 мг/сут, 1 нед). Затем, группа пациенток была рандомизирована на прием 2 г/сут D-маннозы, 50 мг/сут нитрофурантоина (одного из самых эффективных антибиотиков для терапии цистита) или плацебо в течение 6 месяцев. В течение 6-месячного периода наблюдений рецидивы цистита были зарегистрированы у 98 из 308 пациенток (32%). Частота рецидивов цистита была значительно выше в группе плацебо (60%) по сравнению с группами, получавшими нитрофурантоин (20%) или D-маннозу (15%). В целом, пациентки, принимавшие D-маннозу, характеризовались значительно более низким риском рецидивов цистита (О.Ш. 0,24, 95% ДИ 0,15…0.39, р=0,0001) [49].
Сравнительная оценка безопасности применения D-маннозы и нитрофурантоина в исследовании B. Kranjcec и соавт. показала, что пациенты, получавшие D-маннозу, характеризовались в 3 раза более низким риском побочных эффектов (ОР 0,27, р=0,0001). При этом, единственным побочным эффектом применения D-маннозы являлась легкая диарея (7,8%). В то же время, побочные эффекты при применении нитрофурантоина наблюдались у 27 % пациентов и включали диарею (10%), тошноту (5,8%), ощущение жжения влагалища (8,7%), головную боль (2.9%) и высыпания на коже (0,97%) [49].
При лечении цистита D-маннозой в сочетании с инулином одновременно происходит нормализация кишечной микробиоты, что способствует вытеснению патогенных бактерий. Например, инулин и D-манноза дозозависимо тормозят адгезию и образование биопленок бактерий Clostridium difficile, способствующих развитию диареи [50].
На российском рынке зарегистрирована биологически активная добавка (БАД) Экоцистин на основе синергидной комбинации «D-манноза+инулин». Экоцистин содержит значительные дозы D-маннозы (1500 мг) и инулина (1492,5 мг) в одном саше для приготовления раствора для питья. Этих количеств D-маннозы и инулина вполне достаточно для:
- поддержки полезной микробиоты;
- торможения абсорбции уропатогенных штаммов E.coli;
- оздоровления микробиоты;
- модуляции активности рецептора D-маннозы, D-манноза-связывающего лектина и других D-маннозазависимых белков.
Терапевтический эффект может быть достигнут употреблением одного саше Экоцистина в сутки. При лечении цистита рекомендуется принимать раствор Экоцистина на ночь, сразу после опорожнения мочевого пузыря. Такой режим приема обеспечивает повышенные концентрации D-маннозы и инулина в моче, которые воздействуют на уротелий в течение более длительного времени, чем днем. Назначение Экоцистина на ночь также будет способствовать более эффективному оздоровлению микробиоты кишечника. При лечении тяжелых форм цистита, дозировка Экоцистина может быть увеличена до 2-4 саше в сутки. БАД Экоцистин рекомендуется назначать после проведения беседы с пациентом о питании и о питьевом режиме.
ЗАКЛЮЧЕНИЕ
Приведенные в настоящей работе результаты систематического анализа 33 064 исследований указали на важность D-маннозы для гликозилирования белков, поддержки иммунной, сердечно-сосудистой, мочевыводящей и других систем организма. Нарушения обмена D-маннозы – неотъемлемый компонент патогенеза аутоиммунных заболеваний (сахарного диабета 1-го типа, болезни Крона, ревматоидного артрита и др.). Кроме этого, нарушения уровней и активности D-манноза-зависимых белков ассоциированы с повышенным риском бактериального цистита и опухолевых патологий. Бактериостатические, противовоспалительные и противоопухолевые эффекты D-маннозы усиливаются пребиотиком (метабиотиком) инулином. В сочетании с инулином D-манноза тормозит рост патогенных бактерий и, одновременно, поддерживает рост полезной микробиоты кишечника.
ЛИТЕРАТУРА
- Medus ML, Gomez GE, Zacchi LF, Couto PM, Labriola CA, Labanda MS, et al. N-glycosylation triggers a dual selection pressure in eukaryotic secretory proteins. Sci Rep 2017;7(1):8788. doi: 10.1038/s41598-017-09173-6.
- Rushforth K. Trees of Britain and Europe. (Collins Wild Guide). Harpercollins Pub Ltd; 1999. 1333p
- Postma P.W., Lengeler JW, Jacobson GR. Phosphoenolpyruvate: carbohydrate phosphotransferase systems of bacteria. Microbiol Rev 1993;57(3):543-94.
- Громова О.А., Торшин И.Ю., Галустян А.Н., Сорокин А.И., Иванова М.И. Хемомикробиомный анализ синергизма D-маннозы и D-фруктозы в сравнении с молекулами других метабиотиков. Эффективная фармакотерапия. Урология и нефрология 2020;(2): [Gromova O.A., Torshin I.Yu., Galustyan A.N., Sorokin A.I., Ivanova M.I. Chemomicrobiome analysis of the synergism of D-mannose and D-fructose compared with molecules of other metabiotics. Effektivnaya farmakoterapiya. Urologiya i nefrologiya = Effective pharmacotherapy. Urology and Nephrology 2020;(2): (In Russian)].
- Dalziel M, Crispin M, Scanlan CN, Zitzmann N, Dwek RA. Emerging principles for the therapeutic exploitation of glycosylation. Science 2014;343(6166):1235681. doi: 10.1126/science.1235681.
- Громова О.А., Торшин И.Ю., Тетруашвили Н.К. Систематический анализ исследований по D-маннозе и перспективы ее применения при рецидивирующих инфекциях мочеполовых путей у женщин репродуктивного возраста. Акушерство Гинекология Репродукция 2019;13(2):119–131. doi: 10.17749/2313-7347.2019.13.2.119-131. [Gromova O.A., Torshin I.Yu., Tetruashvili N.K. A systematic analysis of studies on D-mannose and the prospects for its use in recurrent urinary tract infections in women of reproductive age. Akusherstvo Ginekologiya Reproduktsiya. = Obstetrics Gynecology Reproduction. 2019; 13 (2): 119–131. doi: 10.17749 / 2313-7347.2019.13.2.119-131.]
- Porru D, Parmigiani A, Tinelli C, Barletta D, Choussos D, Franco C Di, et al. Oral D-mannose in recurrent urinary tract infections in women: a pilot study. J Clin Urol 2014;7(3): 208-213. doi: 10.1177/2051415813518332
- Torshin IY, Rudakov KV. Combinatorial analysis of the solvability properties of the problems of recognition and completeness of algorithmic models. part 1: factorization approach. Pattern Recognition and Image Analysis 2017;27(1):16-28.
- Torshin I.Yu., Rudakov K.V. On the theoretical basis of metric analysis of poorly formalized problems of recognition and classification. Pattern Recognition and Image Analysis 2015;25(4):577-587.
- Torshin I.Yu., Rudakov K.V. On metric spaces arising during formalization of problems of recognition and classification. part 1: properties of compactness. Pattern Recognition and Image Analysis 2016; 26(2):274-284.
- Красняк С.С. Неантибактериальная терапия и профилактика острого и рецидивирующего цистита: существующие варианты и перспективы. Экспериментальная и клиническая урология 2020;(1):136-143. DOI: 10.29188/2222-8543-2020-12-1-136-143. [Krasnyak S.S. Non-antibacterial therapy and prevention of acute and recurrent cystitis: existing options and future trends. Experimtntal and clinical urology 2020;(1):136-143 (In Russian].
- Торшин И.Ю., Гусев Е.И., Громова О.А., Калачева А.Г., Рудаков К.В. Мировой опыт изучения эффектов омега-3 полиненасыщенных жирных кислот: влияние на когнитивный потенциал и некоторые психические расстройства. Журнал неврологии и психиатрии им. C.C. Корсакова 2011;111(11): 79-86. [Torshin IYu, Gusev EI, Gromova OA, Kalacheva AG, Rudakov KV. International experience in studying effects of omega-3 polyunsaturated fatty acids: the influence on cognitive abilities and some mental disorders. Zhurnal nevrologii i psikhiatrii imeni S.S. Korsakova = S.S. Korsakov Journal of Neurology and Psychiatry 2011;111(11 Pt 1):79-86. (In Russian)].
- Громова О.А., Торшин И.Ю., Калачева А.Г., Грустливая У.Е., Керимкулова Н.В., Гришина Т.Р., Гусев Е.И. Перспективы использования стандартизированных форм омега-3 полиненасыщенных жирных кислот в неврологии. Журнал неврологии и психиатрии им. C.C. Корсакова. 2012;112(1):101-105. [Gromova OA, Torshin IIu, Kalacheva AG, Grustlivaia UE, Kerimkulova NV, Grishina TR, Gusev EI. The perspective lines of using standardized forms of omega-3 polyunsaturated fatty acids in neurology. Zhurnal nevrologii i psikhiatrii imeni S.S. Korsakova = S.S. Korsakov Journal of Neurology and Psychiatry 2012;112(1):101-5. (In Russian)]
- Kondrashova MN, Doliba NM. Polarographic observation of substrate-level phosphorylation and its stimulation by acetylcholine. FEBS Lett. 1989;243(2):153-5. doi: 10.1016/0014-5793(89)80119-x.
- Vlahopoulos S, Gritzapis AD, Perez SA, Cacoullos N, Papamichail M, Baxevanis CN. Mannose addition by yeast Pichia Pastoris on recombinant HER-2 protein inhibits recognition by the monoclonal antibody herceptin. Vaccine 2009;27(34):4704-8. doi: 10.1016/j.vaccine.2009.05.063.
- Ribeiro LZ, Tripp RA, Rossi LM, Palma PV, Yokosawa J, Mantese OC, et al. Serum mannose-binding lectin levels are linked with respiratory syncytial virus (RSV) disease. J Clin Immunol 2008;28(2):166-73. doi: 10.1007/s10875-007-9141-8.
- Chong WP, To YF, Ip WK, Yuen MF, Poon TP, Wong WH, et al. Mannose-binding lectin in chronic hepatitis B virus infection. Hepatology 2005;42(5):1037-45. doi: 10.1002/hep.20891.
- Li TP, Guan SH, Wang Q, Chen LW, Yang K, Zhang H. Soluble mannose receptor as a predictor of prognosis of hepatitis B virus-related acute-on-chronic liver failure. World J Gastroenterol 2019;25(37):5667-5675. doi: 10.3748/wjg.v25.i37.5667.
- Arboleda Alzate JF, Rodenhuis-Zybert IA, Hernández JC, Smit JM, Urcuqui-Inchima S. Human macrophages differentiated in the presence of vitamin D3 restrict dengue virus infection and innate responses by downregulating mannose receptor expression. PLoS Negl Trop Dis 2017;11(10):e0005904. doi: 10.1371/journal.pntd.0005904.
- Mu J, Hirayama M, Sato Y, Morimoto K, Hori K. A Novel high-mannose specific lectin from the green alga hHalimeda renschii exhibits a potent anti-influenza virus activity through high-affinity binding to the viral hemagglutinin. Mar Drugs 2017;15(8). pii: E255. doi: 10.3390/md15080255.
- Zhang W, Bouwman KM, van Beurden SJ, Ordonez SR, van Eijk M, Haagsman HP, et al. Chicken mannose binding lectin has antiviral activity towards infectious bronchitis virus. Virology 2017;509:252-259. doi: 10.1016/j.virol.2017.06.028.
- Ferrannini E, Bokarewa M, Brembeck P, Baboota R, Hedjazifar S, Andersson K, et al. Mannose is an insulin-regulated metabolite reflecting whole-body insulin sensitivity in man. Metabolism 2020;102:153974. doi: 10.1016/j.metabol.2019.153974.
- Lee SJ, Evers S, Roeder D, Parlow AF, Risteli J, Risteli L, et al. Mannose receptor-mediated regulation of serum glycoprotein homeostasis. Science 2002;295(5561):1898-901.
- Szolnoky G, Bata-Csörgö Z, Kenderessy AS, Kiss M, Pivarcsi A, Novák Z, et al. A mannosebindingreceptor is expressed on human keratinocytes and mediates killing of Candidaalbicans. J Invest Dermatol 2001;117(2):205-13.
- Gazi U, Martinez-Pomares L. Influence of the mannose receptor in host immuneresponses. Immunobiology 2009;214(7):554-61. doi: 10.1016/j.imbio.2008.11.004.
- Swale A, Miyajima F, Kolamunnage-Dona R, Roberts P, Little M, Beeching NJ, et al. Serum mannose-binding lectin concentration, but not genotype, is associated with Clostridium difficile infection recurrence: a prospective cohort study. Clin Infect Dis 2014;59(10):1429-36. doi: 10.1093/cid/ciu666.
- Farrokhi M, Dabirzadeh M, Dastravan N, Etemadifar M, Ghadimi K, Saadatpour Z, et al. Mannose-binding lectin mediated complement pathway in autoimmune neurological disorders. Iran J Allergy Asthma Immunol 2016;15(3):251-6.
- Zhang WF, Li ZT, Fang JJ, Wang GB, Yu Y, Liu ZQ, et al. Effect of mannose on the lung function of rats with acute pancreatitis. J Biol Regul Homeost Agents 2018;32(3):627-633.
- Gan J, Dou Y, Li Y, Wang Z, Wang L, Liu S, et al. Producing anti-inflammatory macrophages by nanoparticle-triggered clustering of mannose receptors. Biomaterials 2018;178:95-108. doi: 10.1016/j.biomaterials.2018.06.015.
- Tanino T, Egawa K. Suppression of natural cytotoxicity in tumor-bearing mice and inhibition of the suppression by D-mannose. Jpn J Exp Med 1985;55(4):155-60.
- Liu DR, Guan QL, Gao MT, Jiang L, Kang HX. Mannose receptor as a potential biomarker for gastric cancer: a pilot study. Int J Biol Markers 2017;32(3):e278-e283. doi: 10.5301/jbm.5000244. PMID: 28085174.
- Gu J, Liang D, Pierzynski JA, Zheng L, Ye Y, Zhang J, et al. D-mannose: a novel prognostic biomarker for patients with esophageal adenocarcinoma. Carcinogenesis 2017;38(2):162-167. doi: 10.1093/carcin/bgw207.
- Fukuda H, Matsuzawa T, Abe Y, Endo S, Yamada K, Kubota K, et al. Experimental study for cancer diagnosis with positron-labeled fluorinated glucose analogs: [18F]-2-fluoro-2-deoxy-D-mannose: a new tracer for cancer detection. Eur J Nucl Med 1982;7(7):294-7. doi: 10.1007/BF00253423.
- Furumoto S, Shinbo R, Iwata R, Ishikawa Y, Yanai K, Yoshioka T, et al. In vitro and in vivo characterization of 2-deoxy-2-18F-fluoro-D-mannose as a tumor-imaging agent for PET. J Nucl Med. 2013;54(8):1354-61. doi: 10.2967/jnumed.112.113571.
- Li T, Dong ZR, Guo ZY, Wang CH, Zhi XT, Zhou JW, et al. Mannose-mediated inhibitory effects of PA-MSHA on invasion and metastasis of hepatocellular carcinoma via EGFR/Akt/I?B?/NF-?B pathway. Liver Int 2015;35(4):1416-29. doi: 10.1111/liv.12644.
- Fondy TP, Emlich CA. Haloacetamido analogues of 2-amino-2-deoxy-D-mannose. Syntheses and effects on tumor-bearing mice. J Med Chem 1981;24(7):848-52. doi: 10.1021/jm00139a016.
- Ferrannini E, Bokarewa M, Brembeck P, Baboota R, Hedjazifar S, Andersson K, et al. Mannose is an insulin-regulated metabolite reflecting whole-body insulin sensitivity in man. Metabolism 2020;102:153974. doi: 10.1016/j.metabol.2019.153974.
- Gonzalez PS, O'Prey J, Cardaci S, Barthet VJA, Sakamaki JI, Beaumatin F, et al. Mannose impairs tumour growth and enhances chemotherapy. Nature 2018;563(7733):719-723. doi: 10.1038/s41586-018-0729-3.
- Singh J, Rivenson A, Tomita M, Shimamura S, Ishibashi N, Reddy BS. Bifidobacterium longum, a lactic acid-producing intestinal bacterium inhibits colon cancer and modulates the intermediate biomarkers of colon carcinogenesis. Carcinogenesis 1997;18(4):833-41. doi: 10.1093/carcin/18.4.833.
- Yin Y, Wang RR, Wang Y, Wang JJ, Xu GX. Preparation of selenium-enriched Bifidobacterium longum and its effect on tumor growth and immune function of tumor-bearing mice. Asian Pac J Cancer Prev 2014;15(8):3681-6. doi: 10.7314/apjcp.2014.15.8.3681
- Xu J, Chen D, Liu C, Wu XZ, Dong CX, Zhou J. Effect of inulin-type fructans in patients undergoing cancer treatments: A systematic review. Structural characterization and anti-tumor effects of an inulin-type fructan from Atractylodes chinensis. Int J Biol Macromol 2016;82:765-71. doi: 10.1016/j.ijbiomac.2015.10.082. PMID: 26522246.
- Taper HS, Roberfroid MB. Inhibitory effect of dietary inulin or oligofructose on the development of cancer metastases. Anticancer Res 2000;20(6B):4291-4.
- Thøgersen R, Gray N, Kuhnle G, Van Hecke T, De Smet S, Young JF, et al. Inulin-fortification of a processed meat product attenuates formation of nitroso compounds in the gut of healthy rats. Food Chem 2020;302:125339. doi: 10.1016/j.foodchem.
- Mazraeh R, Azizi-Soleiman F, Jazayeri SMHM, Noori SMA. Effect of inulin-type fructans in patients undergoing cancer treatments: A systematic review. Pak J Med Sci 2019;35(2):575-580. doi: 10.12669/pjms.35.2.701.
- Becerril-Alarcón Y, Campos-Gómez S, Valdez-Andrade JJ, Campos-Gómez KA, Reyes-Barretero DY, Benítez-Arciniega AD, et al. Inulin supplementation reduces systolic blood pressure in women with breast cancer undergoing neoadjuvant chemotherapy. Cardiovasc Ther 2019;2019:5707150. doi: 10.1155/2019/5707150.
- Аполихина И.А., Саидова А.С. Гиперактивный мочевой пузырь. Акушерство и гинекология 2019;(S3/1):15-18. [Apolikhina I.A., Saidova A.S. Overactive bladder. Akusherstvo i ginekologiya = Obstetrics and gynecology 2019;( S3 /1):15-18. (In Russian)]
- Сычева Е.Г., Аполихина И.А. Коррекция эстроген-дефицитных состояний у женщин с урогенитальными расстройствами. Акушерство и гинекология 2015;( 4): 75-79. [Sycheva E.G., Apolikhina I.A. Correction of estrogen-deficient conditions in women with urogenital disorders. Akusherstvo i ginekologiya = Obstetrics and gynecology 2015;( 4):75-79. (In Russian)]
- Громова О.А., Торшин И.Ю., Тетруашвили Н.К. Систематический анализ исследований по D-маннозе и перспективы ее применения при рецидивирующих инфекциях мочеполовых путей у женщин репродуктивного возраста. Акушерство Гинекология Репродукция 2019;13(2):119–131. doi: 10.17749/2313-7347.2019.13.2.119-131. [Gromova O.A., Torshin I.Yu., Tetruashvili N.K. A systematic analysis of studies on D-mannose and the prospects for its use in recurrent urinary tract infections in women of reproductive age. Akusherstvo Ginekologiya Reproduktsiya = Obstetrics Gynecology Reproduction 2019;13(2):119–131. doi: 10.17749 / 2313-7347.2019.13.2.119-131. (In Russian)]
- Kranjcec B, Papes D, Altarac S. D-mannose powder for prophylaxis of recurrent urinary tract infections in women: a randomized clinical trial. World J Urol 2014;32(1):79-84. doi: 10.1007/s00345-013-1091-6.
- Piotrowski M, Wultańska D, Obuch-Woszczatyński P, Pituch H. Fructooligosaccharides and mannose affect Clostridium difficile adhesion and biofilm formation in a concentration-dependent manner. Eur J Clin Microbiol Infect Dis 2019;38(10):1975-1984. doi: 10.1007/s10096-019-03635-7.