Шкодкин С.В., Фиронов С.А., Идашкин Ю.Б., Любушкин А.В., Невский А.А.
Почечно-клеточный рак в стадии T3a-T3c характеризуется формированием опухолевого тромба в просвете венозного русла почки с распространением по нижней полой вене (НПВ) вплоть до правого предсердия, при этом у многих пациентов отсутствуют метастазы [1, 2]. Хирургическое лечение данной стадии заболевания сопряжено с рядом технических сложностей, в частности необходимостью работы на магистральных сосудах с применением ангиопластических приемов, мобилизации печени и т.д. [3, 4]. Несомненным является высокий риск интраоперационных осложнений, среди которых жизнеугрожающим, наряду с гемодинамическими и тромбоэмболическими осложнениями, является большой объем кровопотери, приводящий в ряде наблюдений к развитию геморрагического шока и ДВС-синдрома [4-6]. По данным разных авторов, кровопотеря составляет в среднем от 750 до 3500 мл, в отдельных случаях достигая значений 13500-27000 мл [7, 8]. Столь высокие цифры кровопотери сохраняются, несмотря на совершенствование хирургической техники, анестезиологического пособия и тщательный отбор пациентов для выполнения оперативного вмешательства, обусловливая риск периоперационной летальности в 0,416% наблюдений [9-11].
ТЕХНИЧЕСКИЕ ОСОБЕННОСТИ НЕФРЭКТОМИИ В АСПЕКТЕ СНИЖЕНИЯ ИНТРАОПЕРАЦИОННОЙ КРОВОПОТЕРИ
Интралюминальный рост почечно-клеточного рака существенно изменяет анатомию и гемодинамику венозной системы забрюшинного пространства, создавая трудности хирургического лечения данной стадии заболевания (высокий риск неконтролируемых кровотечений, тромбоэмболии и др.) не только на сосудистом этапе вмешательства, но и непосредственно при удалении почки [12].
На этапе нефрэктомии некоторые исследователи отмечают в качестве основного источника кровопотери во время операции резко расширенные коллатеральные вены забрюшинного пространства [13]. Данная тенденция отмечена при опухолях правой почки, что связано с блоком венозного оттока по короткой почечной вене опухолевой тканью. А.В. Сухарев и соавт. указывают на вовлечение в кровоток при правостороннем поражении мелких капсулярных, надпочечниковых, нижних диафрагмальных и мочеточниковых вен, не имеющих в большинстве случаев прямой связи с правой почечной веной [14]. По указанным венозным ветвям происходит дренаж венозной крови главным образом в бассейн полунепарной вены, и далее в систему притоков плечеголовного ствола. В бассейн этой вены впадают множественные стволы, имеющие связь с ретрокавальной венозной системой на уровне каудального отдела нижней полой вены. Возникает гипертензия и варикозная трансформация в коллатеральных венах, локализованных в области сосудистой ножки почки [15, 16]. Этот факт, а также частое повреждение тонкостенных вен с развитием трудно поддающегося коррекции кровотечения, обусловливает трудности мобилизации почечной артерии в области латеральнее НПВ [17, 18]. Данная проблема обуславливает сложившееся мнение большинства авторов о необходимости перевязки почечной артерии до выполнения мобилизации почки и тромбэктомии [2, 19]. Одним из возможных маневров при правостороннем опухолевом процессе является выделение и перевязка правой почечной артерии в аортокавальном промежутке с предшествующим смещением левой почечной вены в каудальном или краниальном направлении. Тем самым достигается снижение кровопотери из вышеуказанных капсульных и паранефральных венозных коллатералей на этапе выделения почки
Другим способом прекращения артериального притока и минимизации повреждения расширенных венозных коллатералей является описанный G. Ciancio и соавт. метод, заключающийся в выделении почки с фасцией Герота с латеральной и задней стороны с медиальной ротацией, что обеспечивает возможность перевязки почечной артерии, как при трансторакальных доступах [19]. Авторы не отмечали большой кровопотери и признаков тромбоэмболии легочной артерии при применении данного метода во время операции у 42 пациентов. Д.В. Щукин и соавт. предостерегают, что использование указанной выше методики обязательно должно сопровождаться контролем верхушки опухолевого тромба, т.к. сама по себе ротация тромбированной почечной вены создает риск фрагментации тромба с последующей тромбоэмболией [17].
ЗНАЧЕНИЕ ПРЕДОПЕРАЦИОННОЙ ЭМБОЛИЗАЦИИ ПОЧЕЧНОЙ АРТЕРИИ
Внедрение рентгеноэндоваскулярной окклюзии почечной артерии, проводимой перед основным хирургическим вмешательством, потенциально призвано создать условия для минимизации кровопотери как на этапе нефрэктомии, так и при венокавотромбэктомии [20]. При этом отмечается уменьшение венозных коллатералей забрюшинного пространства, уменьшение размеров тромба и инфраренальной опухоли. Ряд исследователей считают оптимальным срок выполнения основного вмешательства через 24 часа после эмболизации, когда еще не успевают развиться проявления постэмболизационного синдрома (боли в боковых отделах живота, диспепсия, лихорадка, выраженная слабость) [21, 22]. Другие авторы считают оптимальными сроки эмболизации в пределах 48-72 часов [23]. Однако применение данного метода ограничено вероятностью развития некроза опухолевого тромба, его спонтанной фрагментации и, как следствие фатальной тромбоэмболии легочной артерии (ТЭЛА) [6]. J. Fichtner и соавт. отмечают, что при неполной окклюзии просвета почечной артерии тромбом, наоборот, повышается риск интраоперационной кровопотери [24]. Несомненным является также риск окклюзии не только ипсилатеральной почечной артерии, но и других артериальных ветвей (кишечника, спинного мозга, контралатеральной почки) [25]. Таким образом, данная методика не может считаться оптимальным способом выключения артериального кровотока в хирургии рака почки с интралюминальной венозной инвазией, диктуя необходимость тщательной предоперационной оценки риска возможных осложнений.
СОСУДИСТЫЙ ЭТАП ХИРУРГИИ РАКА ПОЧКИ С ИНТРАЛЮМИНАРНОЙ ИНВАЗИЕЙ
На этапе тромбэктомии объем кровопотери, несомненно, увеличивается. По данным М.И. Давыдова и соавт. частота интраоперационных осложнений данного вмешательства достигает 24,6%, при этом острая массивная кровопотеря в их структуре доминирует (24,0%) [7]. Мобилизация НПВ сопряжена с высоким риском травматизации магистральных сосудов и других соседних структур на фоне измененной анатомии забрюшинного пространства. Авторами установлена корреляционная связь длительности венокавотромбэктомии и операционной кровопотери с клиническими признаками обструкции НПВ, свидетельствующими о значительной распространенности опухолевого тромбоза, характеристиками опухолевого тромба, включая его размеры, границы, инвазию притоков НПВ, а также врастание в венозную стенку, и техническими особенностями операции.
Основными мероприятиями по снижению интраоперационной кровопотери на этапе венокаватромбэктомии являются васкулярная изоляция пораженного сегмента НПВ путем наложения турникетов дистальнее и проксимальнее опухолевого тромба и на контрлатеральную почечную вену, а также контроль притоков НПВ на указанном участке [26-28].
Классическая васкулярная изоляция, включающая наложение турникетов на контралатеральную почечную вену, а также проксимальный и дистальный отрезки нижней полой вены, не избавляет в ряде ситуаций от активного поступления крови из просвета НПВ при каватомии, что диктует необходимость контроля ее притоков [29, 30]. В ряде работ, посвященных вариантной анатомии венозных притоков НПВ, значение диаметра вены более 3 мм является критерием возникновения значимого кровотечения [31, 32]. Пристальное внимание данному вопросу уделил в своих исследованиях Д.В. Щукин и соавт., которые считают, что в большинстве случаев причиной такого кровотечения является поступление крови из поясничных вен [26]. Особые трудности контроля указанных вен и их частая травматизация обусловлены вариабельностью размеров и локализации, тонкой стенкой и локализацией устьев по задней поверхности НПВ: диаметр указанных вен составлял в среднем 3,8 мм (от 1 до 10 мм), наиболее частая их локализация отмечалась в субренальном сегменте, чаще примерно на 6 часах условного циферблата, при этом общее число устьев поясничных вен на указанном отрезке варьировало от 3 до 9. Авторы выделили потенциальную «зону риска» (участок НПВ длиной 10 мм ниже устья ипсилатеральной почечной вены) наиболее частое место локализации устьев верхних поясничных вен, подчеркивая важность их контроля при васкулярной изоляции тромба (рис. 1). Связь поясничных вен с позвоночным венозным сплетением (система полунепарной вены) в условиях повышенного давления в коллатералях также является фактором высокого риска кровопотери. Также оценивались правая надпочечниковая вена, устье которой выявлено авторами в подпеченочном (31,4%) и ретропеченочном отделах НПВ. Значение правых надпочечниковых вен, несмотря на средний диаметр устья 4,6 мм, по мнению авторов, невелико ввиду низкого объема кровотока в надпочечнике.
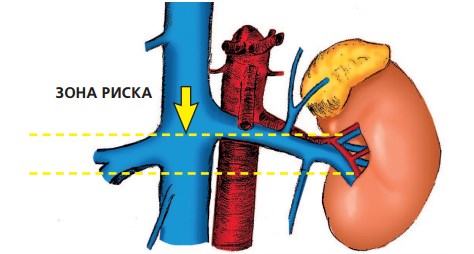
Рис. 1. Потенциальная «зона риска» локализации устья верхней поясничной вены в области васкулярной изоляции опухолевого тромба НПВ (по данным Щукина Д.В. и соавт.,[33])
При подпеченочном и ретропеченочном уровнях опухолевого тромбоза дополнительной манипуляцией, сопряженной с высоким риском сосудистой травматизации, является мобилизация печени, обеспечивающая доступ к указанным сегментам НПВ [33].
Ю.Г. Аляев и соавт. указывают на необходимость контроля нижних печеночных вен, выявляемых не во всех наблюдениях [12]. Указанные притоки в диаметре не превышают 2 мм и имеют малую длину, что обуславливает технические особенности их лигирования, а именно наложение сосудистого зажима с захватом стенки НПВ в области их устья с последующим ушиванием культи сосудистым швом после лигирования. Исследования хирурговгепатологов указывают на наличие более чем в 30% наблюдений от 1 до 5 добавочных печеночных вен, исходящих из хвостатой доли печени, распределение устьев которых в области ретропеченочного сегмента НПВ было довольно случайным [34].
Немногочисленные анатомические исследования указывают на наличие еще одного потенциального источника кровопотери при каватромбэктомии – вариантной поясничной вены, впадающей в НПВ по ее задней поверхности (рис. 2), выявляемой в 34,3 – 38,8 % [26, 35].
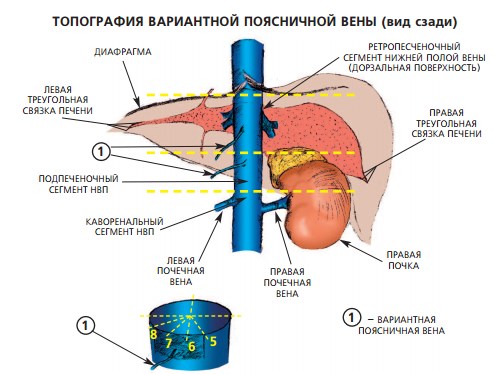
Рис. 2. Топография вариантной поясничной вены (по данным Abbasi и соавт. Щукин Д.В. и пр., [26, 35])
A. Abbasi и соав. указывают на локализацию устья поясничной вены в ретропеченочном отделе (расстояние до устья правой почечной вены составляло 7,4 см) и средний диаметр 3,7 мм, что позволило авторам подчеркнуть потенциальную значимость данной анатомической структуры в развитии кровотечения в указанном сегменте НПВ [35]. Однако, в работе Д.В. Щукина и соавт. вариантная поясничная вена имела меньший диаметр (в среднем 1,5 мм), распределение ее устьев отмечалось в ретропеченочном сегменте лишь в 8,3% наблюдений (в каворенальном сегменте – в 25%, подпеченочном – в 66,7%) [26]. Таким образом, данная проблема требует последующего изучения и выявления клинической значимости.
Применение в хирургии супрадиафрагмальных опухолевых тромбов метода кардиопульмонального шунтирования, способствующего снижению риска эмболических осложнений, увеличивает риск интраи послеоперационных геморрагических осложнений вследствие коагулопатии на фоне системной гепаринизации [36]. Так, в работе G. Staehler и соавт. данная проблема отмечена в 28,5% наблюдений, что стало причиной летального исхода у 14,2% пациентов [37]. Это обусловило разработку хирургических доступов к супрадиафрагмальному сегменту НПВ со стороны брюшной полости, анализ которых представлен в работах Д.В. Щукина и соавт. [38]. Указаны методики внутриперикардиальной изоляции НПВ через продольную и поперечную диафрагмотомию и перикардиотомию, а также путемформирования «окна» в диафрагме и перикарде [1, 27, 36, 39, 40]. В аспекте рассматриваемой проблемы геморрагических осложнений при указанных доступах имеется риск повреждения задней стенки НПВ и развития неконтролируемого кровотечения, ввиду того, что при наложении турникета перфорируются оба листка перикарда и проведение инструмента происходит вслепую. Внеперикардиальные доступы включают циркулярную диафрагмотомию, описанную G. Ciancio и соавт. [41], и широкую продольную диафрагмотомию, предложенную S. Mizuno и соавт. [42]. При циркулярной диссекции НПВ от сухожильного центра диафрагмы имеется риск повреждения правого диафрагмального нерва, приводящего к параличу правого купола диафрагмы, и диафрагмальных вен. Отмечено, что в большинстве наблюдений устья диафрагмальных вен были локализованы на уровне диафрагмы или ниже нее (93,9%), преимущественно на передней полуокружности (93%) (рис. 3). Диаметр устьев на этом уровне варьировал от 1 до 6 мм (средний диаметр 2,6 мм). В супрадиафрагмальном отделе устья были локализованы в 7 из 115 случаев (6,1%) на передней и передне-боковой окружности справа, их диаметр варьировал от 1 до 2 мм. При выполнении в данном исследовании доступов к супрадиафрагмальному отделу НПВ, авторы выявили травматизацию диафрагмальных вен преимущественно при циркулярной и поперечной диафрагмотомии, указывая при этом на отсутствие трудностей проведения гемостаза с учетом малого диаметра вен и возможности их визуализации в связи с локализацией на передней полуокружности [38].
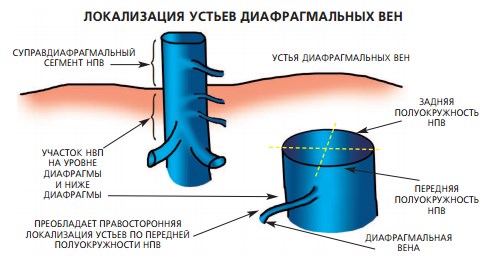
Рис. 3. Локализация устьев диафрагмальных вен (по данным Щукин Д.В. и соавт. [13])
ЗАКЛЮЧЕНИЕ
Хирургическое лечение рака почки с инвазией в нижнюю полую вену сопряжено с техническими трудностями как на этапе нефрэктомии, так и на сосудистом этапе операции [12]. Следствием этого является высокий риск (около ¼ случаев) интраоперационных осложненией (гемодинамических, геморрагических, эмболических, органной недостаточности и др.), коррелирующий с уровнем распространения тромба [7]. Оправданность выполнения этих операций связана с тем, что нередко они носят радикальный характер [2].
Измененная анатомия коллатерального венозного русла на фоне блока НПВ тромбом, вариабельность притоков НПВ, коагулопатии, необходимость манипуляций на магистральных сосудах и связанные с ними гемодинамические сдвиги в жизненно важных органах, объясняют преобладание в структуре осложнений данного вида хирургии острой кровопотери, приводящей к грозным последствиям в виде геморрагического шока и ДВС-синдрома, приводящим к летальному исходу [4, 5].
В последние годы отмечается значительный прогресс в лечении данной стадии заболевания вследствие совершенствования предоперационного обследования и отбора пациентов, анестезиологического пособия, внедрения техник сосудистой, торакальной хирургии, трансплантологии [3, 16]. Однако в мировой литературе отмечены трудные моменты данной хирургии связанные, в частности, с выбором оптимального способа сосудистой изоляции тромба, контроля вариабельно расположенных притоков НПВ, особенностей анатомии каждого отдела НПВ, изучению которых посвящено крайне ограниченное количество исследований.
Таким образом, дальнейшее изучение анатомии НПВ и ее притоков, а также совершенствование хирургической техники при раке почки, осложненном венозной инвазией, основной путь снижения риска интраоперационных осложнений, в первую очередь геморрагических.
ЛИТЕРАТУРА
1.Давыдов М.И., Матвеев В.Б.Хирургическое лечение больных раком почки с опухолевым тромбозом почечной и нижней полой вены. // Онкоурология. 2005. № 2. С. 8–15.
2. Linder BJ, Boorjian SA, Blute ML. Management of Renal Cell Carcinoma with Vena Caval Atrial Extension. // AUA update series. 2013. Vol. 32, N 8. P. 77-88.
3. Белов Ю.В., Комаров Р.Н. Хирургия рака почки с опухолевым тромбозом нижней полой вены и правого предсердия. // Хирургия. 2013. N 1. С. 65-69.
4. Lawindy SM, Kurian T, Kim T. Important surgical considerations in the management of renal cell carcinoma (RCC) with inferior vena cava (IVC) tumour thrombus. // BJU Int. 2012. Vol. 110, N 7. P. 926–939.
5. Матвеев В.Б. Хирургическое лечение осложненного венозной инвазией и метастатического рака почки: Автореф. дисс. ... докт. мед. наук. М. 2002. 47 с.
6. Jennings SB, Austenfeld MS, Basham K. Fatal pulmonary embolus from ischemic necrosis of intracaval tumor thrombus: a case report. // J. Urol. 1993. N 150. P. 1492–1495.
7. Давыдов М.И., Матвеев В.Б., Волкова М.И. Факторы прогнозы непосредственных результатов тромбэктомии у больных раком почки с опухолевым венозным тромбом. // Онкоурология. 2014. N 3. С. 31-39.
8. Hon-Ting Lok, Eddie SY Chen, Simon SM Hou. Surgical management ofrenal cell carcinoma with inferior vena cava thrombus. // Surgical practice. 2014. Vol. 18, N 2. P. 60-66.
9. Blute ML, Leibovich BC, Lohse CM. e Mayo Clinic experience with surgical management, complications and outcome for patients with renal cell carcinoma and venous tumour thrombus. // BJU Int. 2004. N 94. P. 33–41.
10. Kaag MG, Toyen C, Russo P. Radical nephrectomywith vena caval thrombectomy: a contemporary experience. // BJU Int. 2011. N 107. P. 1386–1393.
11.Abel EJ,ompson RH, Margulis V. Perioperative outcomesfollowing surgicalresection ofrenal cell carcinoma with inferior vena cava thrombus extending above the hepatic veins: a contemporary multicenter experience.// Eur. Urol. 2014. Vol. 66, N 3. P. 584-592.
12. Аляев Ю.Г., Григорян В.А., Крапивин А.А. Опухоль почки. М.: Гэотар-Мед, 2002. 56 с.
13. Атдуев В.А.,Амоев З.В., Бельский В.А.Анализ постоперационных осложнений после тромбэктомии из нижней полой вены при раке почки. // Современные технологии в медицине. 2012. № 2. С. 51-56.
14. Сухарев А.В., Кошечкина Н.А., Пашков Ю.В. Сосудистая инвазия системы нижней полой вены у детей с нефробластомой: общие сведения, классификация и стадирование (обзор литературы). // Детская онкология. 2005. N 3. C. 36-45.
15. Переверзев А.С. Хирургия опухолей почки и верхних мочевых путей. Харьков: Lora Medpharm, 1997. С. 167-254.
16. González J, Gorin MA, Garcia-Roig M, Ciancio G. Inferior vena cava resection and reconstruction: Technical considerations in the surgical management of renal cell carcinoma with tumor thrombus. // Urologic Oncology. 2014. Vol. 32, N 1. P. 19-34.
17. Щукин Д.В. Контроль почечной артерии при удалении опухолевых тромбов из просвета нижней полой вены: варианты хирургической стратегии. // Международный медицинский журнал. 2014. № 1. С. 61-64.
18. Skinner DG, Pritchett TR, Lieskovsky G. Vena caval involvement by renal cell carcinoma. Surgical resection provides meaningful long-term survival. // Ann. Surg. 1989. N 210. P. 387–394.
19. Ciancio G, VaidyaA, Soloway M. Early ligation of the renal artery using the posterior approach: a basic surgical conceptreinforced during resection of large hypervascularrenal cell car¬cinomawith orwithout inferior vena cava thrombus. // BJU Int. 2003. Vol. 92, N 4. P. 488–489.
20. Schwartz MJ1, Smith EB, Trost DW, Vaughan ED Jr. Renal artery embolization: clinical indications and experience from over 100 cases. // BJU Int. 2007.Vol. 99, N 4. P. 881-886.
21. Карелин М.И., Атрощенко А.В., Школьник М.И. Комбинированное лечение больных локализованным и местнораспространенным почечноклеточным раком с применением предоперационной артериальной эмболизации. // Вопросы онкологии. 2008. Том 54. № 1. С. 95-97.
22. Kalman D, Varenhorst E. e role of arterial embolization in renal cell carcinoma. // Scand. J. Urol. Nephrol. 1999. N 33. P. 162–170.
23. Nesbitt JC, Soltero ER, Dinney CPN. Surgical management of renal cell carcinoma with inferior vena cava tumor thrombus. // Ann. Thorac. Surg. 1997. N 63. P. 1592–1600.
24. Fichtner J1, Swoboda A, Hutschenreiter G, Neuerburg J. Percutaneous embolization of the kidney: Indications and clinical results. // Aktuelle Urol. 2003. Vol. 34, N 7. P. 475–477
25. Lin P.H., Bush RL, Eraso A, Zhou W. Intraoperative renal artery embolization with concomitant nephrectomy. A novel treatment approach for renal cell carcinoma, with potential benefits of cost saving and reduction of postinfarction syndrome. // Endovascular Today. 2005. N 11. P. 28-38.
26. Щукин Д.В. Поиск источников кровотечения из просвета нижней полой вены при венокавотромбэктомии. Анатомическое исследование. // Онкоурология. 2014. N 1. С. 16-24.
27. Belgrano E, Trombetta C, Siracusano S. Surgical Management of Renal Cell Carcinoma (RCC) with vena cava tumour thrombus. // Eur. Urol. Suppl. 2006. 5:610–618.
28. Kwon TW, Kim H, Moon KM, Cho YP, Song C, Kim CS, Ahn H. Surgical management of inferior vena cava tumor thrombus in patients with renal cell carcinoma. // JAREM. 2013. N 3. P. 47-52.
29. Boorjian SA, Sengupta S and Blute ML. Renal cell carcinoma: vena caval involvement. // BJU Int. 2007. N 99. P. 1239.
30. Clayman RV, Gonzalez R, Fraley EE. Renal cell cancer invading the inferior vena cava: clinical review and anatomical approach. // J Urol. 1980. Vol. 123, N 2. P. 157-163.
31. Baniel J, Foster RS, Donohue JP. Surgical anatomy of the lumbar vessels: implications for retroperitoneal surgery. // J. Urol. 1995. Vol. 153, N 5. P. 1422-1425.
32. Sato TJ, Hirai I, Murakami G. An anatomical study of short hepatic veins, with special reference to delineation of the caudate lobe for hanging maneuver of the liver without the usual mobilization. // J. Hepatobil. Pancr. Surg. 2002. Vol. 9, N 1. P. 55–60.
33. Cerwinka WH, Manoharan M., Soloway MS, Ciancio G. The role of liver transplantation techniques in the surgical management of advanced renalurothelial carcinoma with or without inferior vena cava thrombus. // Int. Braz. J. Urol. 2009. Vol. 35, N 1. P. 19-23.
34. Kogure K, Kuwano H, Fujimaki N. Relation among portal segmentation, proper hepatic vein, and external notch of the caudate lobe in the human liver. // Ann. Surg. 2000. Vol. 231, N 2. P. 223–228.
35. Abbasi A, Johnson TV, Kleris R. Рosterior lumbar vein of the retrohepatic inferior vena cava: a novel anatomical variant with surgical implications. // J. Urol. 2012. Vol. 187, N 1. P. 296-301.
36. Bassi P, Dal Moro F, Ciaccia M. Transdiaphragmatic intrapericardiac approach to supradiaphragmatic vena cava invasion secondary to renal cell carcinoma: a novel surgical approach. // Urology. 2005. Vol. 66, N 5. P. 1101-1105.
37. Staehler G., Brkovic D. The role of radical surgery for renal cell carcinoma with extension into the vena cava. // J. Urol. 2000. Vol. 163, N 6. P. 1671-1675.
38. Щукин Д.В. Анализ возможности выполнения и безопасности хирургических доступов к супрадиафрагмальному отделу нижней полой вены и правому предсердию со стороны брюшной полости при удалении опухолевых внутривенозных тромбов. // Здоровье мужчины. 2013. N 1. С. 42-47.
39. Miyazaki M., Ito H., Nakagawa K.. An approach to intrapericardial inferior vena cava through the abdominal cavity, without median sternotomy, for total hepatic vascular exclusion. // Hepatogastroenterology. 2001. N 48. P. 1443–1446.
40. Chen T. W., Tsai C. H., Chou S. J.. Intrapericardial isolation of the inferior vena cava through a transdiaphragmatic pericardial window for tumor resection without sternotomy or thoracotomy. // Eur. J. Surg. Oncol. 2007. N 33. P. 239–242.
41. Ciancio G., Soloway MS. Renal cell carcinoma with tumor thrombus extending above diaphragm: avoiding cardiopulmonary bypass. // Urology. 2005. N 66. P. 266–270.
42. Mizuno S., Kato H., Azumi Y.. Total vascular hepatic exclusion for tumor resection: a new approach to the intrathoracic inferior vena cava through the abdominal cavity by cutting the diaphragm vertically without cutting the pericardium. // J. Hepatobiliary Pancreat. Sci. 2010. N 17. P. 197–202.