Журнал "Экспериментальная и клиническая урология" Выпуск №3 за 2015 год
Баринов Э.Ф., Твердохлеб Т.А., Кравченко А.Н., Баринова М.Э.
Развитие гематурии в условиях мочекаменной болезни (МКБ) обусловлено рядом факторов: характеристиками конкремента, наличием инфекции мочевыводящих путей (МВП), реактивностью клеток крови, состоянием системы гемостаза и т.п. [1]. Механизмы возникновения, поддержания и прекращения таких «транзиторных» кровотечений не привлекают должного внимания урологов. В ряде случаев рекомендуется проведение гемостатической терапии и установка стента в лоханку или мочеточник для профилактики их обструкции «сгустками» крови после литотрипсии (ЛТ) [2]. Однако, при внимательном анализе ситуации появляется много вопросов на которые нет ответов: влияет ли размер и локализация конкрементов в МВП на выраженность гематурии после ЛТ, как связано хроническое и острое воспаление в условиях хронического обструктивного пиелонефрита (ХОПН) с вероятностью кровотечения, изменяется ли функциональная активность тромбоцитов после ЛТ и как это влияет на ограничение гематурии, от чего зависит вариабельность гематурии и т.д.? Как следствие, дефицит знаний порождает неоднозначность трактовки тяжести кровопотери после ЛТ. Логичной выглядит концепция о зависимости выраженности гематурии от индивидуальной реактивности системы гемостаза. В свою очередь, реактивность тромбоцитарного звена гемостаза может модулироваться различными гуморальными, параи аутокринными регуляторами [3]. Можно предположить, что если при уролитиазе или после проведении ЛТ происходит активация симпато-адреналовой системы (повышается концентрация катехоламинов в крови), то адренореактивность тромбоцитов изменяется, а это будет проявляться изменением тромбогенеза.
Цель исследования – установить зависимость гематурии при уролитиазе и после ЛТ от индивидуальной реактивности тромбоцитов.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 67 пациентов с хроническим обструктивным пиелонефритом, которые поступили в урологическое отделение для проведения литотрипсии. Диагноз хронического обструктивного пиелонефрита верифицирован на основании жалоб больных, анамнеза заболевания, объективного осмотра, результатов клиниколабораторных и инструментальных исследований. Кавитационную контактно-фрезевую ультразвуковую ЛТ проводили с помощью аппарата Karl Storz-Calcuson. При анализе гемограммы (гемоанализатор ABX Pentra XL 80-HORIBA, Франция) определяли количество форменных элементов, лейкоцитарную формулу и абсолютное количество различных видов лейкоцитов. Для объективной оценки гематурии, развивающейся после ЛТ, подсчитывали количество эритроцитов в 1 мл мочи при исследовании по Нечипоренко. Оценку агрегации тромбоцитов (Тц) проводили на агрегометре Chronolog (USA) с использованием агонистов в концентрациях ЕС50, вызывающих амплитуду агрегации 50% у здоровых лиц. Тромбоциты выделяли путем центрифугирования из цитратной периферической крови. Для анализа функционального состояния тромбоцитов использовали следующие агонисты: АДФ и адреналин (Sigma) – 5 мкМ. Все клинические исследования выполнены по согласованию с комиссией по биоэтике Донецкого национального медицинского университета им. М. Горького. Статистическую обработку результатов проводили в пакетах MedStat и MedCalc. Статистически значимую достоверность констатировали при р< 0,05.
РЕЗУЛЬТАТЫ
Через 24 ч после ЛТ у 53 (79,1%) больных имела место микрогематурия (1-я группа) – количество эритроцитов составило 18,5±10,9х103 Эр/мл (95% ДИ 1,0 – 58,5х103 Эр/мл). У 14 (20,9%) пациентов отмечена макро-гематурия (2-я группа) – количество эритроцитов в моче достигало 250±64,8х103 Эр/мл (95% ДИ 142,5– 450х103 Эр/мл). Можно было предположить, что выраженность гематурии зависит от локализации и размера конкремента (табл. 1). Проведенный анализ показал, что в 1-й группе при расположении конкремента в лоханке (средний размер конкремента – 30,0±5,6 мм) величина гематурии после ЛТ составила 59,3±10,6х103 Эр/мл; при этом не выявлено статистически значимой корреляции между данными показателями (r=0,211; р = 0,730). При локализации конкремента (12,0±7,9 мм) в мочеточнике количество эритроцитов в моче после ЛТ составляло 3,25±5,3х103 Эр/мл. Для 2-й группы характерен больший размер конкремента в лоханке (на 13,3%; р=0,11); величина гематурии после ЛТ составила 250±83,9х103 Эр/мл; статистически значимой корреляции между исследованными показателями не обнаружено (r=0,113; р=0,667). В случае локализации конкремента в мочеточнике (14,0±1,7 мм) величина гематурии составила 33,1±26,7х103 Эр/мл; корреляционная связь между размером конкремента и выраженностью гематурии повышалась и достигала средней силы (r=0,59; р>0,05).
Наличие более выраженной послеоперационной гематурии при локализации конкрементов в лоханке по сравнению с мочеточником в обеих группах может быть связана с продолжительностью ЛТ (косвенно с размером и химическим составом конкремента), и подтверждает целесообразность использования индикаторов локализации и размера конкремента в МВП для прогнозирования осложнений ЛТ.
Является ли воспаление при уролитиазе предиктором гематурии? Проведенные исследования показали, что на этапе госпитализации при ремиссии ХОПН (количество лейкоцитов в общем анализе крови находилось в диапазоне от 4х109 до 9х109/л) гематурия составила 161,2±47,3х103 Эр/мл. В фазу рецидива заболевания (лейкоцитоз>9х109 /л) количество эритроцитов в моче достигало 290,0±67,4х103 Эр/мл (р< 0,05). Таким образом, создается впечатление, что воспаление ограничивает тромбогенез. Через 24 ч после ЛТ отсутствует статистически значимая разница лейкоцитоза при микрои макрогематурии (табл. 2). Тем не менее, в обеих группах после малоинвазивного оперативного вмешательства проявляется реакция лейкоцитов на повреждение слизистой оболочки лоханки или мочеточника – при микрогематурии количество лейкоцитов увеличивается на 24,4% (р=0,0074), а при макрогематурии на 47,9% (р=0,0068). Наличие слабой положительной корреляционной связи между количеством эритроцитов в моче и лейкоцитозом при микрогематурии (r1= 0,383; р=0,308) и сильной (r2= 0,825; р=0,001) при макрогематурии подтверждает взаимосвязь нарушения тромбогенеза и острого воспаления в мочевыводящих путях.
Таблица 1. Характеристика пациентов с уролитиазом в зависимости от результата литотрипсии
| Показатели | 1-я группа (микрогематурия) |
2-я группа (макрогематурия) |
|---|---|---|
| Локализация конкремента в почке | 17 (32%) | 4 (28,6%) |
| Локализация конкремента в мочеточнике: верхняя треть; средняя треть; нижняя треть. |
33 (62,3%) 12 5 16 |
8 (57,1 %) 5 0 3 |
| Сочетанные конкременты | 3(5,7%) | 2 (14,3 %) |
| Всего | 53 | 14 |
Таблица 2. Индикаторы воспаления у пациентов с хроническим обструктивным пиелонефритом
| Показатели | 1-я группа (микрогематурия) |
2-я группа (макрогематурия) |
|---|---|---|
| СОЭ, мм/час: до литотрипсии; после литотрипсии. |
16,0±2,9 10,0±2,7 |
18,5± 6,3 19,0±5,3• |
| Лейкоциты крови х 109/л: до литотрипсии; после литотрипсии. |
8,6±0,5 10,7±1,1••• |
7,3±0,3 10,8±1,0••• |
| Нейтрофилы, %: до литотрипсии; после литотрипсии |
65,0±2,9 74,0±2,2•• |
64,0± 2,9 72,5±2,6• |
| Нейтрофилы абс., х 109/л: до литотрипсии; после литотрипсии |
5,4±0,5 6,2±0,9 |
4,4±0,3 5,6±0,7 |
| Количество лейкоцитов в моче, х 103/мл: до литотрипсии; после литотрипсии |
15,2±53,3 3,5±12,6 |
37,5±75,3 42,5±18,0** |
*Демонстрирует достоверность различий на уровне p <0,05; ** р<0,01 по отношению к 1-й группе
• на уровне p<0,05; •• p<0,01; ••• p<0,001 по отношению показателя до литотрипсии
Обращает на себя внимание, что при макрогематурии выраженный лейкоцитоз (более 9х109/л) сопровождался индивидуальной вариабельностью количества эритроцитов в моче (от 250 до 550х103 /мл). Реакция лейкоцитов проявляется повышением нейтрофилоцитопоэза – при микрогематурии относительное количество сегментоядерных нейтрофилов увеличивается на 13,8% (р=0,0044), а при макрогематурии на 13,3% (р=0,0269). Необходимо подчеркнуть, что абсолютное количество нейтрофилов крови после ЛТ находится в пределах референтного диапазона, то есть данный индикатор острого воспаления не подтверждает рецидив ХОПН. При анализе абсолютного количества нейтрофилов не обнаружено межгрупповой статистически значимой разницы (р=0,723), хотя более выраженная тенденция к нейтрофилоцитозу после ЛТ имела место при макрогематурии (на 26,6%; р< 0,05). На этом фоне интересным представляется анализ динамики СОЭ, как традиционного индикатора развития воспаления. При микрогематурии после ЛТ на фоне повышения количества лейкоцитов и нейтрофилов, величина СОЭ снижалась до референтных значений (на 37,5%; р=0,277). Вероятно, при микрогематурии реакция лейкоцитов на альтерацию слизистой оболочки мочевыводящих путей сохраняется в течение 24 ч после ЛТ, тогда как механизмы реализации воспаления (например, синтез острофазных белков в печени, влияющих на СОЭ) в данный интервал времени – лимитируются. В этом случае, реакция лейкоцитов представляется более инертной, но оправданной с точки зрения возможности рецидива воспаления. При макрогематурии СОЭ устойчиво сохраняется на уровне до ЛТ и, таким образом, указанный лейкоцитоз отражает поддержание воспалительной реакции в мочевыводящих путях. В этом контексте лейкоцитурия более манифестно демонстрирует указанную выше динамику воспалительной реакции при микрои макрогематурии. В 1-й группе через 24 ч после ЛТ количество лейкоцитов в моче уменьшилось в 4,3 раза, а во 2й группе лейкоцитурия не изменилась. При этом наличие статистически значимой межгрупповой разницы (р=0,0024) количества лейкоцитов в моче после ЛТ подтверждает присутствие воспаления в мочевыводящих путях у пациентов с макрогематурией. Сильная положительная корреляционная связь между количеством эритроцитов и лейкоцитов в моче при микрогематурии (r1 = 0,709; р=0,0104) и слабая (r2 = 0,309; р=0,305) – при макрогематурии свидетельствуют, что лейкоцитурия в диапазоне от 0 до 50х106/л связана с выраженностью гематурии; при выходе за границы такого диапазона взаимосвязь утрачивается. Вероятно, при превышении критического порога воспаления в мочевыводящих путях, макрогематурия в большей степени определяется другими факторами (например, снижением реакции тромбоцитов на агонисты).
Таким образом, воспалительная реакция в стенке мочевыводящих путей может влиять на гемостаз, поскольку лейкоциты могут модулировать функциональную активность тромбоцитов благодаря секреции биологически активных веществ.
Вариабельность гематурии после ЛТ у пациентов обеих групп побуждает к изучению индивидуальной реактивности тромбоцитов на основные агонисты. Представляют интерес и компенсаторные возможности тромбоцитов, позволяющие ограничить кровотечение. Исследовательский вопрос: изменяется ли реактивность тромбоцитов на адреналин и АДФ при микрои макрогематурии у пациентов через 24 ч после выполнения литотрипсии?
В 1-й группе после проведения ЛТ определялась гипореактивность тромбоцитов в отношении адреналина и АДФ (рис. 1). Следует отметить, что АДФ-индуцированная агрегация тромбоцитов дои после ЛТ (соответственно 37,0±4,9% и 37,0±3,1%) статистически значимо не различалась (p>0,05), тогда как реакция тромбоцитов на адреналин (19,8±1,8%; p>0,05) снижалась после элиминации конкремента. Во 2-й группе через 24 ч после ЛТ адренореактивность (35±8,4%) в 1,8 раз превышала аналогичный показатель 1-й группы (р=0,02); на этапе, предшествующем ЛТ, различий в агрегации тромбоцитов при действии адреналина между двумя группами не обнаруживалось (р=0,37). АДФ-индуцированная агрегация тромбоцитов дои после литотрипсии была: (а) нормореактивной (соответственно 52,5±6,1% и 57,0±12,5%); (б) статистически значимо превышала аналогичные показатели в 1-й группе (р до ЛТ=0,0427 и р после ЛТ=0,0096). Данный результат подтверждает участие обоих агонистов в регуляции тромбогенеза при возникновении макрогематурии. Различный эффект АДФ и адреналина на тромбоциты у пациентов с микрои макрогематурей после литотрипсии, является отражением индивидуальной реактивности тромбоцитов у пациентов с уролитиазом.
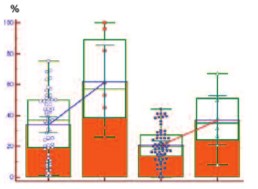
Рис. 1. Межгрупповые различия индуцированной агрегации тромбоцитов (%) после литотрипсии
ОБСУЖДЕНИЕ
В литературе отсутствует единая точка зрения относительно влияния локализации и размера конкрементов на развитие гематурии после ЛТ. Так, R. Kukreja и соавт. [4] считают, что размер камня и инфекция МВП не оказывают существенного влияния на кровопотерю при проведении ЛТ. Противоположной точки зрения придерживаются P.E. Fuganti и соавт. [5], которые выделяют среди предикторов развития кровопотери после ЛТ размер (р=0,001) и расположение конкремента (р=0,001). O. Tanriverdi и соавт. [6] приводят убедительные доказательства того, что расположение камня в верхней части мочеточника сопровождается значительным увеличением частоты осложнений после ЛТ, в т.ч. гематурии. Проведенное нами исследование показало, что в течении 24 ч после ЛТ возможно развитие как микро, так и макрогематурии. Тот факт, что выраженность гематурии коррелирует с воспалением (в частности, с лейкоцитозом), отражает наличие влияния лейкоцитов на функциональную активность тромбоцитов, вследствие секреции фактора активации тромбоцитов (ФАТ), активных форм кислорода, катепсина G, адгезивных молекул и др. [7].
Известно, что выраженность кровотечения зависит от состояния тромбоцитарного звена гемостаза. Это обосновывает проведение исследования функционального состояния тромбоцитов при уролитиазе с целью установления особенностей их регуляции после ЛТ. Очевидно, что от эффективности механизмов, обеспечивающих активацию тромбоцитов при снижении их ответа на агонисты (реализация компенсаторных реакций тромбоцитов), будет зависеть ограничение гематурии. В этом контексте имеет смысл аппелировать к наличию вторичной волны при регистрации агрегации тромбоцитов, связанной с секрецией АДФ из плотных гранул. Биологический смысл существования такой защитной реакции заключается в возможности амплификации внешнего сигнала [8]. Установлено, что при воздействии агонистов, прежде всего слабых (адреналина), развивается нестабильный ответ тромбоцитов, при котором не достигается их критической активации (выход на стационарное состояние) и тромбоцитарный агрегат распадается [9]. В физиологических условиях часто складывается ситуация когда уровень адреналина в крови кратковременно повышается и выступает в роли триггера активации тромбоцитов, однако при этом тромбогенез невозможен [10]. При патологических условиях (в т.ч. альтерации слизистой мочевыводящих путей) критическая активация тромбоцитов (необратимый ответ), во многом базируется на секреции содержимого плотных гранул, прежде всего АДФ, который обеспечивает переход функции тромбоцитов на новый стационарный уровень, известный как «плато кривой агрегации». По сути, АДФ, секретируемый тромбоцитами, усиливает эффект их первичной стимуляции агонистом и инициирует тромбогенез у пациентов. Не менее интересной представляется гипотеза об усилении паракринного стимулирующего эффекта АДФ при повышении в циркулирующей крови адреналина. Данная гипотеза основана на известной сопряженности α2-адренорецепторов и пуриновых рецепторов тромбоцитов с Giбелком сигнальных путей, реализующих повышение функциональной активности тромбоцитов [11].
В группе пациентов с макрогематурией после проведенной ЛТ выявлена гипоадренореактивность и нормореактивность в отношении АДФ, при этом выраженность индукции аггрегации тромбоцитов in vitro обоими агонистами была выше, чем при микрогематурии. Несмотря на это, у пациентов с макрогематурией эффективного ограничения кровопотери в течение 24 ч часов после ЛТ не происходило. Вероятно, это связано со снижением ко-активации внутриклеточных сигнальных систем при низкой реактивности тромбоцитов на адреналин. Известно, что адреналин и АДФ реализуют свое действие через общий сигнальный путь Gi – Akt, хотя при этом активируются различные рецепторы – соответственно α2 – адренорецепторы и пуриновые рецепторы – Р2Y12 и Р2Y1 [12]. Поэтому, взаимодействие этой пары агонистов может рассматриваться как механизм потенцирования функциональной активности тромбоцитов и ограничения гематурии. Что касается микрогематурии, то при прочих равных условиях (размер и локализация конкремента, наличие хронического воспаления) ограничение кровопотери – воспроизводится. Данный факт может рассматриваться как следствие компенсаторной реакции тромбоцитов, развивающейся под влиянием спектра биологически активных молекул (в т.ч. агонистов) после ЛТ, однако адреналин и АДФ в данном случае не являются ключевыми регуляторами тромбогенеза.
Таким образом, при наличии микрои макрогематурии после ЛТ приходится сталкиваться с индивидуальной реактивностью организма и ее проявлением – сенситивностью рецепторов тромбоцитов к адреналину и АДФ. Последняя определяется не только геномной характеристикой мегакариобласта (полиморфизмом генов), но и может зависеть от модулирующего влияния патогенетических факторов хронического обструктивного пиелонефрита. Можно надеяться, что расширение знаний о молекулярных механизмах компенсаторной реакции тромбоцитов при развитии кровотечения позволит оптимизировать тактику управления гематурией при уролитиазе и после ЛТ.
ВЫВОДЫ
Pазмер и локализация конкремента, активность воспалительного процесса и изменение индивидуальной реактивности тромбоцитов необходимо учитывать в анализе факторов, модулирующих выраженность гематурии при уролитиазе и после проведения литотрипсии, что позволит не только прогнозировать степень гематурии, но и своевременно и эффективно проводить медикаментозную коррекцию и профилактику кровопотери.
ЛИТЕРАТУРА
1. Sing RI, Singal RK. What is significant hematuria for the primary care physician? // Can J Urol. 2012. Vol. 1. P. 36-41.
2. Sharp VJ, Barnes KT, Erickson BA. Assessment of asymptomatic microscopic hema-turia in adults. // Am Fam Physician. 2013. Vol. 88. N 11. P. 747-754.
3. Баринов Э.Ф., Сулаева О.Н., Гнилорыбов А.М. Тромбоциты. Донецк, 2012, Новый мир. 324 с.
4. Kukreja R, Desai M, Patel S, Bapat S, Desai M. Factors affecting blood loss during percutaneous nephrolithotomy: prospective study.// J Endourol BJU Int. 2004. Vol. 18. N 8. P. 715-722.
5. Fuganti PE, Pires S, Branco R, Porto J. Predictive factors for intraoperative complications in semirigid ureteroscopy: analysis of 1235 ballistic ureterolithotripsies. // Urology. 2008. Vol. 72. N 4. P. 770-774.
6. Tanriverdi O, Silay MS, Kadihasanoglu M, Aydin M, Kendirci M, Miroglu C. Revisiting the predictive factors for intra-operative complications of rigid ureteroscopy: a 15-year experience. // Urol J. 2012. Vol. 9. N 2. P. 457-464.
7. Berndt M, Metharom CP, Andrews RK. Primary haemostasis:newer insights. // Haemophilia. 2014. Vol. 20. N 4. P. 15-22.
8. Golebiewska EM, Harper MT, Williams CM, Savage JS, Goggs R, Fischer von Mollard G, Poole AW. Regulates Platelet Dense Granule Secretion, Aggregation and Thrombus Stability. // Chem. 2014. Vol. 17. P. 602-615.
9. Sagdilek E, Sebik O, Celebi G. Does the magnetic field of a magnetic stirrer in an optical aggregometer affect concurrent platelet aggregation? // Bioelectromagnetics. 2013. Vol. 34. N 5. P. 349-357.
10. Hayes C, Kitahara S, Tcherniantchouk O. Decreased threshold of aggregation to low-dose epinephrine is evidence of platelet hyperaggregability in patients with thrombosis. // Hematol Rep. 2014. Vol. 26. N. 6. P. 532-536.
11. Баринов Э. Ф., Сулаева О. Н., Канана Н.Н., Твердохлеб Т.А. Пуриновые рецепторы и сопряженные внутриклеточные сигнальные системы в регуляции функции тромбоцит. // Кардиология. 2014. Т. 54. № 2. Стр. 56-62.
12. Rivera J, Lozano ML, Navarro-Núñez L, Vicente V. Platelet receptors and signaling in the dynamics of thrombus formation. // Haematologica. 2009. Vol. 94. N. 5. P. 700-711.
- Войдите на сайт для отправки комментариев